
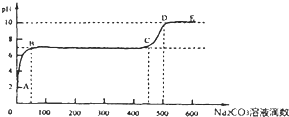
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3- | H2SO4 | O2- | 35Cl |


科目:高中化学 来源: 题型:
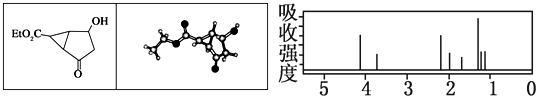
| A、右图中最强吸收峰与最弱吸收峰高度比为3:2 |
| B、该有机物分子中含有4个手性碳原子 |
| C、键线式中的Et代表的基团为-CH3 |
| D、该有机物在一定条件下能够发生消去反应和取代反应,但不能发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到平衡时,SO2的浓度与SO3的浓度相等 |
| B、相同状况下,反应2SO3(g)?2SO2(g)+O2(g)是一个吸热反应 |
| C、为了提高SO2转化率,可适当提高O2浓度 |
| D、升高温度,放热反应的速率增大,吸热反应的速率也增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
| 3 | 63 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
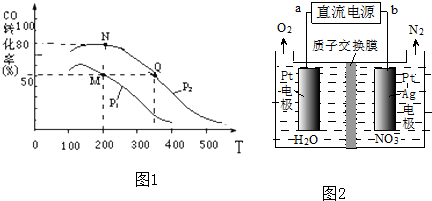
查看答案和解析>>
科目:高中化学 来源: 题型:
 燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com