
����Ŀ��2Zn(OH)2ZnCO3���Ʊ�����ZnO���м��壬��п��ɰ����Ҫ�ɷ�ΪZnO��������Cu2+��Mn2+�����ӣ�Ϊԭ���Ʊ�2Zn(OH)2ZnCO3�Ĺ����������£�

��ش��������⣺
��1����(NH4)2SO4��NH3��H2O�Ļ����Һ�д���c(NH4+)��2c(SO42 - )ʱ����Һ�� �����������������������������ԡ�
��2������ȡ��ʱΪ�����п�Ľ����ʣ��ɲ�ȡ�Ĵ�ʩ�� ����дһ�֣���
��3������ȡ��ʱ�����NH3��H2O����������MnO2�����ӷ���ʽΪ ��
��4������S2-�ܽ�Cu2+������ת��Ϊ�����������ȥ����ѡ��ZnS���г��ӣ��Ƿ���У��ü���˵��ԭ�� ��
[��֪��Ksp(ZnS)��1.6��10-24��Ksp(CuS)��1.3��10-36]
��5������п�������ӷ���ʽΪ ��
��6��������3��������Һ��ѭ��ʹ�ã�����Ҫ�ɷֵĻ�ѧʽ�� ��
��������1���У���2�����衢�ʵ����ȣ�3��Mn2+��H2O2��2NH3��H2O��MnO2����2NH4+��2H2O
��4��������ZnS��Cu2+��CuS��Zn2+��K��![]() ��1.2��1012����1��105
��1.2��1012����1��105
��5��3Zn2+��6HCO3����2Zn��OH��2ZnCO3����5CO2����H2O��6����NH4��2SO4
��������
�����������1����������غ��֪c��H+��+c��NH4����= c��OH������2c��SO42��������Һ��c��NH4������2c��SO42����������c��H+��= c��OH�����������Һ�����ԡ�
��2������ȡ��ʱΪ�����п�Ľ����ʣ��ɲ�ȡ�Ĵ�ʩ�����衢�ʵ�������
��3������ȡ��ʱ�����NH3��H2O��������������Һ��˫��ˮ��������������MnO2�����ӷ���ʽΪMn2+��H2O2��2NH3��H2O��MnO2����2NH4+��2H2O��
��4����������ʽZnS��Cu2��CuS��Zn2+��֪����Ӧ��ƽ�ⳣ��K��![]() =
=![]() ��1.2��1012����1��105������ǿ��еġ�
��1.2��1012����1��105������ǿ��еġ�
��5������ԭ���غ��֪����п��ʱ���ɵ�A�����Ƕ�����̼����Ӧ�����ӷ���ʽΪ3Zn2+��6HCO3 -��2Zn��OH��2ZnCO3����5CO2����H2O��
��6��������3��������Һ����������泥���ѭ��ʹ�ã�����淋Ļ�ѧʽΪ��NH4��2SO4��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ�������ȷ�Ӧ����
A. ŨH2SO4����ˮ B. ��ʯ������ˮ
C. þ��ϡ���ᷴӦ D. NH4Cl������Ba(OH)2��8H2O���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��һ���������ۼ��뵽װ��200 mLijŨ�ȵ�ϡ������Һ�������г�ַ�Ӧ��
��������ʣ��m1 g���ۣ��ռ���NO��״�������Ϊ672 mL��
������Һ�����ʵĻ�ѧʽ ��ԭ������Һ�����ʵ���Ũ�� mol/L��
���������̡�Һ���������μ���ϡ���ᣬֱ�����ٲ���NO����Ϊֹ����ʱ�����л�ʣ������m2 g
���ʱ��Һ�����ʵĻ�ѧʽ ��m1-m2 ��ֵΪ g����ȷ��0.1g )
(2)�����������Խ��Al������ȼ�ϵ��ͨ����NaCl��Һ��KOH��ҺΪ�������Һ��ͨ������ĵ缫Ϊ�������Զ��ʯīΪ�������ϡ�����NaCl��ҺΪ�������Һ�������ķ�ӦʽΪ______________������KOH��ҺΪ�������Һ������ܷ�ӦΪ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�10 mL 0.4 mol/LH2O2��Һ�������ֽ⡣��ͬʱ�̲������O2�������������Ϊ��״�������±���
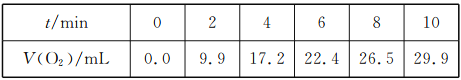
��������������ǣ���Һ����仯���Բ��ƣ��� ��
A����Ӧ��6 minʱ��c(H2O2)=0.20mol/L
B����Ӧ��6 minʱ��H2O2�ֽ���40%
C��0��6 min��ƽ����Ӧ���ʣ�v(H2O2)��3.3��10-2 mol��L-1��min-l
D��6��10 min��ƽ����Ӧ���ʣ���(H2O2) <3.3��10-2 mol��L-1��min-l
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷�ӦZn��2FeCl3===ZnCl2��2FeCl2���һ��ԭ��ء�
��1������ͼ�����ڻ���ʵ��װ��ͼ��
��2��ָ����������Ϊ__________���缫��ӦʽΪ______________________��
��������Ϊ____________���缫��Ӧ����Ϊ_________________________��
��3�����·�еĵ����Ǵ�____________������__________����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.5���ij��̬��ֻ����0.5������������ӳɷ�Ӧ,�����ȴ��飬0.5 mol���ȴ������3 mol����������ȫ��ȡ����Ӧ��������Ľṹ��ʽΪ( )
A��CH2��CH2 B��CH3CH��CH2 C��CH3CH3 D��CH3CH2CH��CH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̬ũҵ�漰ũ�ҷ��ϵ��ۺ����á�ij�ַ��Ͼ����͵õ�һ�ֺ��м��顢������̼�������Ļ������8.96L����״������������ͨ��ʢ�к�ɫCuO��ĩ��Ӳ�ʲ����ܣ������ķ�ӦΪ��CH4��4CuO ![]() CO2����2H2O����4Cu����������ȫ��Ӧ��Ӳ�ʲ����ܵ�����������4.8g������Ӧ������ͨ��2L 0.1mol/L�ij���Ca(OH)2��Һ��������գ����ɳ���10g��
CO2����2H2O����4Cu����������ȫ��Ӧ��Ӳ�ʲ����ܵ�����������4.8g������Ӧ������ͨ��2L 0.1mol/L�ij���Ca(OH)2��Һ��������գ����ɳ���10g��
��1��ԭ�����������ʵ����� �����ɳ�����Ħ�������� ��
��2��ԭ��������м��������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2.0mol PCl3��1.0mol Cl2�������������ܱ������У���һ�������·���������Ӧ��PCl3+Cl2![]() PCl5����ƽ��ʱ��PCl5Ϊ0.40mol�������ʱ����1.0mol PCl3��0.50mol Cl2������ͬ�¶����ٴ�ƽ��ʱPCl5�����ʵ����ǣ� ��
PCl5����ƽ��ʱ��PCl5Ϊ0.40mol�������ʱ����1.0mol PCl3��0.50mol Cl2������ͬ�¶����ٴ�ƽ��ʱPCl5�����ʵ����ǣ� ��
A. 0.40mol B. 0.20mol
C. ��0.20mol D. ����0.20mol����0.40mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com