
暗紫色化合物A具有绿色、高电压和高能量
的特点,近年来引起了电化学界的高度重视。在常温和干燥的条件下,化合物A可以稳定的存在,但它在
水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质。某兴趣小组的同学对化合物A
进行组成分析,确定A中仅含有O、K、Fe三种元素。取3.96g化合物A的粉末溶于水,滴加足量的稀硫
酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,
得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)化合物A的化学式为 ▲ ;化合物A与H2O反应的离子方程式为 ▲ 。
(2)化合物A还可作为一种“绿色高效多功能”水处理剂。原因是 ▲ 。
(3)化合物A的制备还可通过氧化法,试写出在KOH存在条件下用次氯酸钾氧化氢氧化铁制备A的化学方程式 ▲ 。
(4)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高化合物A水溶液稳定性的是 ▲
A.亚硫酸钠 B.KOH C.醋酸 D.Fe(NO3)3
(5)为研究温度对化合物A水溶液稳定性的影响,请设计一个实验方案 ▲ 。
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4) 3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物 质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是
质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是
A.a—b时沉淀的物质的量:A1(OH)3比BaSO4多
B.c—d时溶液中离子的物质的量:AlO2-比Ba2+多
C.a—d时沉淀的物质的量:BaSO4可能小于A1(OH)3
D.d—e时溶液中离子的物质的量:Ba2+不可能等于OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
目前,汽车尾气已成为许多大城市空气的主要污染。汽车尾气中含有CO、NO等多种污染物。
(1)汽车燃料中一般不含氮,尾气中所含的NO产生的原因是 , 化学方程式为 。
(2)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管上装上一个催化转化装置,使NO和CO反应,生成CO2和 N2。反应的化学方程式为 。
(3)下列措施中,能减少或控制汽车尾气污染有效且可行的是 。
① 制定严格的尾气排放标准,并严格执行。 ② 开发清洁能源,如氢能汽车、太阳能汽车等。 ③ 市民出行带防毒面具。 ④ 市民大量移居城市郊区。
查看答案和解析>>
科目:高中化学 来源: 题型:
在重水D2O中存在电离:D2O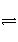
 D++OD-,因此,对D2O可以采用同pH一样的定义来规定pD,即pD=-lg[D+]。已知在某温度下,D2O达电离平衡时,[D+][OD-]=1.6×10-15 mol2·L-2,则纯净的D2O在此温度下的pD________7(填“>”、“<”或“=”)。此温度下,若用0.01 mol DCl溶于D2O配成1 L溶液,pD________;若用0.01 mol NaOD溶于D2O配成1 L溶液时,pD________12(填“>”、“<”或“=”)。
D++OD-,因此,对D2O可以采用同pH一样的定义来规定pD,即pD=-lg[D+]。已知在某温度下,D2O达电离平衡时,[D+][OD-]=1.6×10-15 mol2·L-2,则纯净的D2O在此温度下的pD________7(填“>”、“<”或“=”)。此温度下,若用0.01 mol DCl溶于D2O配成1 L溶液,pD________;若用0.01 mol NaOD溶于D2O配成1 L溶液时,pD________12(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在含有Fe3+、Fe2+、Al3+、NH 的稀溶液中加入足量Na2O2固体,充分作用后,再加入过量稀盐酸,完全反应,则离子数目没有变化的是 ( )
的稀溶液中加入足量Na2O2固体,充分作用后,再加入过量稀盐酸,完全反应,则离子数目没有变化的是 ( )
A.Fe3+、Al3+ B.Al3+
C.Fe2+、NH D.Fe3+
D.Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( )
①金属钠在纯氧中燃烧 ②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间
③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜放入医用酒精中
A.②③①④ B.③②①④
C.③①②④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙三种物质之间有如下转化关系:
甲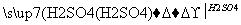 乙
乙 丙
丙 甲
甲
(1)若甲和丙都是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液。
则甲是________,丙是________(填化学式)。写出“乙 丙”转化的离子方程式:______________________________。
丙”转化的离子方程式:______________________________。
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲是______,丙是________(填化学式)。写出“甲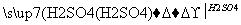 乙”转化的离子方程式:____________________________。
乙”转化的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70% Cu、25% Al、4% Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和 硫酸铝晶体的路线:
硫酸铝晶体的路线:
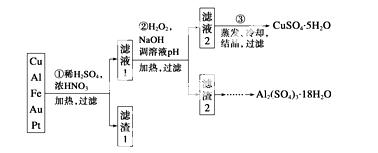
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为________________;得到滤渣1的主要成分为____________。
(2)第②步加H2O2的作用是______________,使用H2O2的优点是______________;调溶液pH的目的是使______________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_______________________。
(4)由滤 渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:

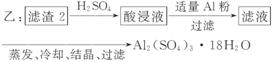
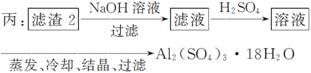
上述三种方案中,________方案不可行,原因是____________________________
_____________________________________________________________________;
从原子利用率角度考虑,__________方案更合理。
(5)探究小组用滴定法测定CuSO4·5H 2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++H2Y2-===CuY2-+2H+
2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++H2Y2-===CuY2-+2H+
写出计算CuSO4·5H2O质量分数的表达式w=______________________________;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
查看答案和解析>>
科目:高中化学 来源: 题型:
把0.05 mol NaOH固体分别加入到100 mL下列液体中,溶液的导电能力变化最小的是( )
A.自来水
B.0.5 mol·L-1盐酸
C.0.5 mol·L-1 CH3COOH溶液
D.0.5 mol·L-1 KCl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com