
S2Cl2是一种重要的化工产品。常温时是一种有毒并有恶臭的金黄色液体,熔点-76℃,沸点138℃,易与水反应,进一步氯化可得SCl2,SCl2是樱桃红色液体,易挥发,熔点-122℃,沸点59℃。SCl2 与S2Cl2相似,有毒并有恶臭,但更不稳定。S2Cl2可用下列装置制备。
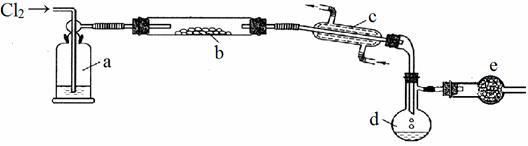
回答下列问题:
(1)写出S2Cl2的电子式_____________________;
(2)写出指定仪器的名称c___________________,d_________________________;
(3)a瓶盛放的试剂是_______________________ ;
(4)b中的反应开始前,需排除装置中的空气,应采取的方法是:_______________________;
(5)装置e中盛放的试剂是_____________其作用是①______________________________ ②___________________________________;
(6)得到纯净的S2Cl2,需要进行的操作是__________;
(7)若将S2Cl2放入水中同时产生沉淀和气体写出反应的方程式
___________________________________________________。
科目:高中化学 来源: 题型:
已建立化学平衡的某可逆反应,当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是( )
①生成物的质量分数一定增加 ②任一生成物总量一定增加
③反应物的转化率一定增大 ④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥一定使用催化剂
A.①②③ B.③④⑤ C.②⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究NaHCO3、Na2CO3与1 mol·L-1盐酸反应设两反应分别是反应Ⅰ、反应Ⅱ)过程中的热效应,进行实验并测得如下数据:
| 序号 | 液体 | 固体 | 混合前温度 | 混合后最高温度 |
| ① | 35 mL水 | 2.5 g NaHCO3 | 20 ℃ | 18.5 ℃ |
| ② | 35 mL水 | 3.2 g Na2CO3 | 20 ℃ | 24.3 ℃ |
| ③ | 35 mL盐酸 | 2.5 g NaHCO3 | 20 ℃ | 16.2 ℃ |
| ④ | 35 mL盐酸 | 3.2 g Na2CO3 | 20 ℃ | 25.1 ℃ |
下列有关说法正确的是 )。
A.仅通过实验③即可判断反应Ⅰ是吸热反应
B.仅通过实验④即可判断反应Ⅱ是放热反应
C.通过实验可判断出反应Ⅰ、Ⅱ分别是吸热反应、放热反应
D.通过实验可判断出反应Ⅰ、Ⅱ分别是放热反应、吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组在网上收集到信息:钠、镁等活泼金属都能在CO2气体中燃烧。
他们对钠在CO2气体中燃烧后得到的白色产物进行了如下探究:
【实验操作】 将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底有黑色颗粒,瓶壁上附着白色物质。
【提出假设】
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
【设计方案】 该小组对燃烧后生成的白色物质进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液。 ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | ①出现白色沉淀。 ②无明显现象 | 白色物质为Na2CO3 |
请回答下列问题:
(1)写出金属镁与二氧化碳反应的化学方程式:____________________________________________________
____________________________________________________。
(2)甲同学认为方案1得到的结论不正确,其理由是____________________________________________________
____________________________________________________。
(3)乙同学认为方案2得到的结论正确,白色物质为____________________________________________________。
(4)钠在二氧化碳中燃烧的化学反应方程式为____________________________________________________
____________________________________________________。
(5)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点,并简述理由:____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验装置进行的相应实验,能达到实验目的的是
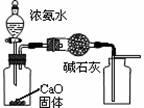
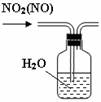
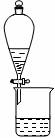
图1 图2 图3 图4
A.用图1装置制取并收集干燥的NH3
B.用图2所示装置可除去NO2中的NO
C.用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液
D.用图4装置制备Fe(OH)2并能较长时间观察其颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
已知: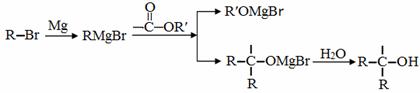
A是一种重要的化工原料,能使溴水反应褪色,且分子内所有的原子都在一条直线上,在不同的条件下,A可以转化为烃B和烃C,B和C的核磁共振氢谱中都只有一个吸收峰,B能使溴水反应褪色而C不能使溴水反应褪色。A~J分别代表一种有机物,并有如下的转化关系:
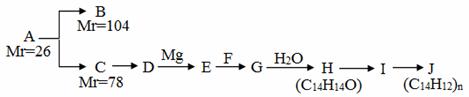
回答下列问题:
(1)A的结构简式为________________;
(2)B的结构简式为_________________;
(3)反应C→D所需要的试剂是_________________________;
(4)H不能发生催化氧化,H的结构简式是____________________________________;
(5) I中的官能团名称是___________________;
(6) I中可能含有的杂质是_____________________(写结构简式);
(7)写出I→J的反应方程式________________________________________________;
(8)H有多种同分异构体,符合下列条件的同分异构体有________种。
①能与FeCl3溶液显紫色;②有二联苯结构;③二联苯上有两个侧链。
其中核磁共振氢谱中吸收峰最少的结构简式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
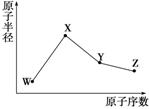 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高正价和最低负价之和为0;Z的非金属性在同周期元素中最强。下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高正价和最低负价之和为0;Z的非金属性在同周期元素中最强。下列说法正确的是( )
A.对应气态氢化物的稳定性:Y>Z
B.化合物XZW既含离子键也含共价键
C.对应简单离子半径:W>X
D.Y的氧化物能与Z或X的最高价氧化物对应的水化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
(1)铝热反应实验:取磁性氧化铁粉按课本中的实验装置(如图)进行铝热反应,将反应后所得“铁块”溶于盐酸,向反应后的溶液中滴加KSCN溶液,发现溶液变血红色。
①出现这种现象的原因,除了因“铁块”中可能混有没反应完的磁性氧化铁外,还有一种可能原因是__________________。
②若要证明反应所得“铁块”中含有金属铝,可用____________(填化学式)溶液,所发生反应的离子方程式为__________________。
(2)化学反应速率影响因素的探究实验:
KI在经酸化的溶液中被空气氧化的反应式为4H++4I-+O2===2I2+2H2O。该反应的速率受温度、酸度、溶剂、试剂浓度等影响,可用淀粉与碘的显色反应来观测该反应的反应速率。已知,淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75 ℃则不能显色;淀粉浓度越高显色越灵敏、颜色也越深。
实验小组拟用0.8 mol·L-1 KI溶液、0.1 mol·L-1 H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A、B、C三组实验,部分实验数据如下表:
| 编 号 | 温度 /℃ | H2SO4 体积 /mL | KI溶液 体积/mL | H2O体 积/mL | 淀粉溶液 /mL | 出现 蓝色 时间 /s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出 现蓝 色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
①为确保A组实验在39 ℃下进行,应采用的控温操作方法是______________________。
②A、B、C三组实验时,都加入了5 mL水,其目的是______________。
③B组实验中“没出现蓝色”,原因是______________。
④请你为小组设计D组实验方案(在表格空白处填入你设计的5个数据),以帮助小组完成探究目标。
⑤根据你设计的实验数据,请你预测一个t值,并写出与你预测相对应的探究实验结论____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,向一个2 L的真空密闭容器中事先装入催化剂,通入1 mol N2和3 mol H2,经过一段时间后,测得容器内压强为反应起始的0.9倍,在此时间内以H2表示的平均速率为0.1 mol·L-1·min-1,则所经过的时间是( )
A.5 min B.4 min C.3 min D.2 min
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com