
【题目】自然界中的氧化铝晶体俗称刚玉,是一种坚硬的晶体。关于刚玉的下列说法中不正确的是
A.都是无色晶体B.熔点高难熔化
C.用于制造机械手表轴承D.用于制造中高档耐火材料
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】性激素、胃蛋白酶、纤维素和DNA中都含有的元素是( )
A. C、H、O B. C、H、O、N
C. C、H、O、N、P D. C、H、O、N、P、S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“分子筛”是一种具有多孔结构的铝硅酸盐(NaAlSiO4·nH2O),其中有许多笼状孔穴和通道,能让直径比孔穴小的分子通过而将大的分子留在外面,故此得名。利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备“分子筛”的一种工艺流程如下:
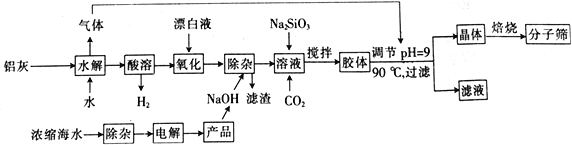
(1)“分子筛”的化学式用氧化物形式可表示为_______________。
(2)铝灰水解产生的气体为________(填化学式);“水解”在加热条件下而不在室温下进行的原因是________________________。
(3)“酸溶”时,发生氧化还原反应的离子方程式为_________________________________。
(4)该工艺中滤渣的颜色为________________________。
(5)某学习小组设计实验模拟从浓缩海水(含Ca2+、Mg2+、SO42-)中提取试剂级NaCl:
![]()
①实验中若向浓缩海水中加入的是Na2CO3浓溶液,则有难溶的Mg2(OH)2CO3生成,同时有气体逸出。该反应的离子方程式为__________________________________。
②该学习小组发现上述实验即使BaCl2用量不足,第Ⅲ步沉淀中依然含有少量BaCO3。从平衡角度分析其原因:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,烧杯甲中盛有少量液态冰醋酸,烧杯乙中盛有NH4Cl晶体,在烧杯乙中再加入适量氢氧化钡晶体[Ba(OH)2·8H2O],搅拌,可观察到冰醋酸逐渐凝结为固体。下列有关判断正确的是( )

A. NH4Cl与Ba(OH)2·8H2O反应的焓变(ΔH)小于0
B. 反应物的总能量高于生成物的总能量
C. 反应中有热能转化为产物内部的能量
D. 反应中断裂的化学键只有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式和结论之间的关系正确的是( )
A. 常温常压下,1g H2在足量Cl2中燃烧生成HCl放出92.3kJ的热量,则热化学方程式可表示为H2(g)+Cl2(g)=2HCl(g)△H= -184.6kJ
B. 甲烷的燃烧热为890.3kJ·mol-1则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
C. 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ·mol-1,则1molNaOH的稀溶液与足量的稀盐酸完全中和,其中和热为57.3kJ·mol-1
D. 500℃.30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H= -38.6kJ·mol-1
2NH3(g) △H= -38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4瓶常用溶液:①BaCl2溶液,②NaCl溶液,③Na2SO4溶液,④CuSO4溶液。不用其他试剂,可通过实验方法将它们一一鉴别开来,鉴别出来的先后顺序可能是( )
A.④①②③B.④②①③C.④①③②D.①④③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池的示意图如下。电池工作时电极上发生的反应为:
![]()
下列关于该电池的叙述正确的是

A. 电池工作时,是将化学能转化为电能
B. 电池工作时,电解质溶液中I-和I3-浓度不断减少
C. 透明导电玻璃上的电势比镀Pt导电玻璃上的电势高
D. 电解质溶液中发生反应:2Ru3++3I-=2Ru2++I3-
查看答案和解析>>
科目:高中化学 来源: 题型:
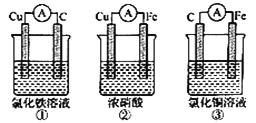
【题目】(1)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______,写出正极的电极反应________。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________。
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。

①实验测得OH-定问移向B电极,则_____处电极入口通甲烷(填A或B),其电极反应式为 ___________。
②当消耗甲院的体积为33.6L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com