
235 92 |
| A、51 | B、92 |
| C、143 | D、235 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、加入碳酸钠固体 |
| B、改用18mol/L的浓H2SO4 |
| C、滴入少量硫酸铜溶液 |
| D、加入硫酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到平衡时,反应速率v正(X)=2v正(Z) |
| B、平衡常数K值越大,X的转化率越大 |
| C、反应速率v正(X)=2v逆(Z),该反应达到平衡状态 |
| D、给反应体系加热,平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| △ |
| A、1种 | B、2种 | C、3种 | D、4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用图1所示装置实验室制取少量Cl2 |
| B、用图2所示装置制取及观察Fe(OH)2 |
| C、图3所示装置用H2O2溶液制备O2 |
| D、用图4所示装置比较S、C、Si的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使甲基橙呈黄色的溶液中一定存在K+、Ba2+、AlO2-、Cl- |
| B、同一主族元素气态氢化物中,相对分子质量越大,沸点越高 |
| C、Al2O3与AlCl3虽然所含的化学键类型不同,但都属于强电解质 |
| D、将过量Na2O2投入紫色石蕊溶液,溶液显蓝色,Na2O2是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下都不能用铝制容器贮存 |
| B、露置在空气中,容器内酸液的浓度都降低 |
| C、常温下都能与铜较快反应 |
| D、滴在紫色石蕊试纸上,试纸都只变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
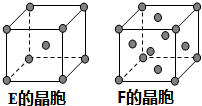 已知A、B、C、D、E、F六种元素的原子序数依次递增,A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;A、E的原子序数相差10,F+的M层电子全充满.请回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
已知A、B、C、D、E、F六种元素的原子序数依次递增,A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;A、E的原子序数相差10,F+的M层电子全充满.请回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com