
分析 (1)生成物浓度的幂之积比上反应浓度的幂之积,固体不代入表达式;①为方程②③之和,所以K1=K2×K3;
(2)反应自发进行的判断依据是△H-T△S<0,反应自发进行,△H-T△S>0,反应非自发进行;
(3)阳极发生氧化反应,锰由+2价变成+4价,结合反应产生大量的氢离子判断电解后溶液pH变化;
(4)原电池的负极失去电子发生氧化反应,正极得到电子发生还原反应,MnO2可做碱性锌锰干电池的正极材料,则二氧化锰得到电子生成MnOOH,据此写出正极的电极反应式.
解答 解:(1)反应①的平衡常数表达式K1=$\frac{{c}^{2}(C{O}_{2})}{c({O}_{2})}$,K1与反应②、③的平衡常数K2、K3关系为:①为方程②的系扩大2倍后与③之和,所以平衡常数K1=K22×K3,
故答案为:$\frac{{c}^{2}(C{O}_{2})}{c({O}_{2})}$;K1=K22×K3;
(2)反应③2MnO+O2?2MnO2为气体体积缩小的反应,其熵变△S<0,该反应在低温下能够自发进行,则满足△H-T△S<0,说明△H必须<0,
只有△H<0,△G<0反应自发,
故答案为:<;
(3)电解池的阳极失去电子发生氧化反应,Mn2+由+2价变成+4价的MnO2,其电极反应为:Mn2++2H2O-2e-=MnO2+4H+,由于反应中产生大量的氢离子,导致电解后溶液的pH将减小,
故答案为:Mn2++2H2O-2e-=MnO2+4H+; 减小;
(4)原电池中负极失去电子,正极得到电子,因此碱性锌锰电池放电时,正极是二氧化锰得到电子,正极的电极反应式为:MnO2+H2O+e-=MnO(OH)+OH-,
故答案为:MnO2+H2O+e-═MnOOH+OH-.
点评 本题考查较为综合,涉及化学平衡常数、原电池、电解池工作原理、反应自发进行的判断等知识,题目难度中等,注意掌握原电池和电解池工作原理,明确反应自发进行的判断方法,试题有利于提高学生的分析能力及灵活应用能力.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.9g水中含有的电子数为NA | |
| B. | 常温常压下,0.2 NA个NH3分子的质量为3.4g | |
| C. | 14.0g由C2H4和C3H6组成的混合气体原子总数为3NA | |
| D. | 1 mol Na变为Na+时失去的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,K值增大 | B. | K值越大,反应物转化率越大 | ||
| C. | 加入催化剂不改变平衡常数K | D. | 平衡向右移动K值不一定改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ③⑤⑥ | C. | ①③⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为0.1mol/L KMnO4标准溶液滴定.
为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为0.1mol/L KMnO4标准溶液滴定.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 30.32 | 25.34 | 25.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
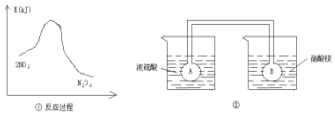 利用图①中的信息,按图②装置链接的A、B瓶中已充有NO2气体.B瓶中的气体颜色比A瓶中的浅(填“深”或“浅”),其原因是2NO?N2O4△H<0,A瓶加热,平衡左移颜色加深,B瓶降低温度,平衡右移颜色变浅.
利用图①中的信息,按图②装置链接的A、B瓶中已充有NO2气体.B瓶中的气体颜色比A瓶中的浅(填“深”或“浅”),其原因是2NO?N2O4△H<0,A瓶加热,平衡左移颜色加深,B瓶降低温度,平衡右移颜色变浅.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Cu2+、H+、Cl-、NO3- | |
| B. | 含有HCO3-的溶液中:K+、OH-、NO3-、Ba2+ | |
| C. | 能与金属Al反应放出H2的溶液中:Na+、NO3-、SO42-、CO32- | |
| D. | 能使酚酞试液呈红色的溶液:Na+、K+、Cl-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com