
研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl===Na2Mn5O10+2AgCl。下列“水”电池在海水中放电时的有关说法正确的是( )
A.正极反应式:Ag+Cl--e-===AgCl
B.每生成1 mol Na2Mn5O10 转移2 mol电子
C.Na+不断向“水”电池的负极移动
D.AgCl是还原产物
科目:高中化学 来源:2017届江苏省苏州市高三上学期期初调研化学试卷(解析版) 题型:选择题
接触法制硫酸工艺三个步骤中的热化学方程式如下:
①4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H1=―3412 kJ·mol-1
②2SO2(g)+O2(g)=2SO3(g) △H2=―196.6 kJ·mol-1
③SO3(g)+H2O(l)=H2SO4(l) △H3=―130.3 kJ·mol-1
A.反应①为吸热反应
B.反应②使用催化剂V2O5,△H2减小
C.反应③在接触室中进行
D.以FeS2为原料,理论上生产2mol H2SO4(l)所释放出的热量为1310.2 kJ
查看答案和解析>>
科目:高中化学 来源:2017届四川省、温江中学等五校高三上第一次联考化学卷(解析版) 题型:选择题
下列有关胶体的说法中,正确的是( )
A.依据丁达尔现象可将分散系分为溶液、胶体与浊液体
B.Fe(OH)3胶体在电场中可作定向移动,是因为Fe(OH)3胶体带电
C.将0.1mol FeCl3滴入沸水中,形成的胶体粒子数目为0.1NA
D.向Fe(OH)3胶体中逐滴滴入2mol/LH2SO4有沉淀生成,继续滴加沉淀溶解
查看答案和解析>>
科目:高中化学 来源:2017届四川省、温江中学等五校高三上第一次联考化学卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是
A.Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+ HClO
B.向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-
C.NH4HCO3溶液和少量的NaOH溶液混合:HCO +OH-===CO
+OH-===CO +H2O
+H2O
D.向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I- = 2Fe2++I2
查看答案和解析>>
科目:高中化学 来源:2017届四川省广元市苍溪县高三零诊理综化学试卷(解析版) 题型:填空题
铝硅合金材料性能优良。铝土矿(含30%SiO2、40.8% Al2O3、和少量的 Fe2O3等)干法制取该合金的工艺如下:
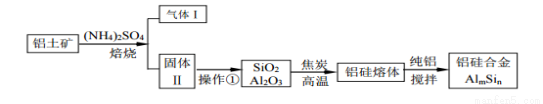
(1)铝硅合金中若含有铁,会影响其抗腐蚀性能,
原因是________________________
(2)焙烧除铁反应时,Fe2O3转化为NH4Fe(SO4 )2,Al2O3 少部分发生类似反应,写出Fe2O3反应的化学方程式: _____氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜的焙烧温度是_______

(3)若操作①所得的溶液中加入过量的NaOH溶液,含铝微粒发生的离子反应方程式是:___________。
(4)用焦炭还原SiO2、 Al2O3 会产生SiC 等中间体。写出中间体SiC再与 Al2O3 生成硅、铝单质的化学反应方程式,并用单线桥标出电子转移方向和数目:_________________。
(5)已知25℃ Ksp[Al(OH)3]=1.0×10-33 , Ksp[Fe(OH)3]=4.0×10-38,向FeCl3和AlCl3的混合溶液中逐滴滴入NaOH溶液,生成Al(OH)3和Fe(OH)3 沉淀,当两种沉淀共存时,上层清液中c(Al3+):c(Fe3+)=____________。
查看答案和解析>>
科目:高中化学 来源:2017届山东省淄博市高三上学期第一次月考化学试卷(解析版) 题型:填空题
铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈(CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作___________剂。
(2)自然界Cr主要以+3价和+6价(Cr2O7-)存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。写出离子方程式:__________________
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:

 ①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为__________。
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为__________。
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是 。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是____________。
④为测定NiSO4·xH2O晶体中x的值,称取26.3 g晶体加热至完全失去结晶水,剩余固体15.5 g,计算x的值等于 。
查看答案和解析>>
科目:高中化学 来源:2017届山东省淄博市高三上学期第一次月考化学试卷(解析版) 题型:选择题
二氧化氯(ClO2)是一种黄绿色易溶于水的气体,常用作饮用水消毒。实验室通过如下过程制备二氧化氯。
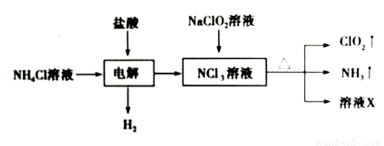
下列说法正确的是
A.电解时发生反应的离子方程式为:NH4++3Cl- 2H2↑+NCl3
2H2↑+NCl3
B.溶液X中大量存在的阴离子有Cl-、OH-
C.可用饱和食盐水除去ClO2中的NH3
D.可用明矾除去饮用水中残留的NaClO2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高一上第一次月考化学试卷(解析版) 题型:填空题
(1)甲烷(CH4)的摩尔质量为 ;相对原子质量为 。
(2)8gCH4中约含有 个分子,在标准状况下所占的体积约为 L;
(3)所含物质的量相等的甲烷和氨气(NH3)的质量比为 。
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上学期第一次统测化学试卷(解析版) 题型:选择题
在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液:Ca2+、、Na+、Cl-、HCO3-
B.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
C.水电离出的c(H+)=10一13mol·L一1的溶液中:K+、、Na+、、SO42-、、AlO2-
D.有较多Fe3+的溶液中:Na+、NH4+、SCN一、HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com