
工业上用闪锌矿(主要成分为ZnS,还含有Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:

(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 。
(2)浸取过程中Fe2(SO4)3的作用是 ,浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 。
(4)置换法除重金属离子所用物质C为 。
(5)硫酸锌的溶解度与温度之间的关系如下表:
|
温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
溶解度/g |
41.8 |
54.1 |
70.4 |
74.8 |
67.2 |
60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为 、 、过滤、干燥。
(1)S(2分)
(2)做氧化剂(2分) Fe2(SO4)3+ZnS=ZnSO4+2FeSO4+S(3分)
(3)4Fe2++O2+6H2O=4FeOOH+8H+(3分)
增大空气与溶液的接触面积,加快反应速率(2分)
(4)Zn(锌)(2分)
(5)60℃条件下蒸发浓缩、降温结晶(2分)
【解析】
试题分析:(1)依据流程转化关系分析判断,加入的硫酸铁具有氧化性能溶解氧化硫化锌、硫化镉,从滤渣A中可获得一种淡黄色非金属单质的副产品为氧化产物为硫,故答案为:S;
(2)依据流程反应和生成硫单质可知,硫酸铁具有氧化性能氧化硫化锌和 硫化镉,生成单质硫,反应的化学方程式为:Fe2(SO4)3+ZnS=ZnSO4+2FeSO4+S,故答案为:做氧化剂; Fe2(SO4)3+ZnS=ZnSO4+2FeSO4+S;
(3)除铁过程控制溶液的pH在5.4左右,利用空气中氧气氧化亚铁离子生成FeOOH,反应的两种方程式为:4Fe2++O2+6H2O=4FeOOH+8H+;在空气入口处设计了一个类似淋浴喷头的装置是为了增大与空气的接触面积增大反应速率,故答案为:4Fe2++O2+6H2O=4FeOOH+8H+;增大空气与溶液的接触面积,加快反应速率;
(4)制备实验方案是制取ZnSO4•7H2O,依据除杂不能引入新的杂质,Cd的金属活动性介于Zn和Fe之间,所以加入锌可以置换镉,故答案为:Zn;
(5)依据图表中硫酸锌的溶解度与温度之间的关系分析,低温和高温溶解度都不是最大,只有在60°C硫酸锌的溶解度最大74.8g,通过加热蒸发浓缩,冷却结晶会最大程度得到晶体,
故答案为:60℃条件下蒸发浓缩、降温结晶.。
考点:考查物质制备方案的流程分析和反应判断,实验流程信息应用等相关知识。


科目:高中化学 来源: 题型:

| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省广州市番禺区高三统考(一)理综化学试卷(解析版) 题型:填空题
工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:(己知Cd的金属活动性介于Zn和Fe之间)

(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 。
(2)浸取过程中Fe2(SO4)3的作用是 ,浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 。
(4)置换法除重金属离子是Cd2+,所用物质C为 。
(5)硫酸锌的溶解度与温度之间的关系如下表:
|
温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
溶解度/g |
41.8 |
54.1 |
70.4 |
74.8 |
67.2 |
60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用闪锌矿(主要成分为ZnS,还含有Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:
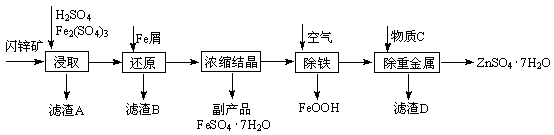
(1)滤渣A经CS2提取后可获得一种淡黄色副产品,其化学式为 。
(2)浸取过程中Fe2(SO4)3的作用是 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 。
(4)硫酸锌的溶解度与温度之间的关系如下表:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为 、 、过滤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com