
 (1)已知:①Fe(s)+
(1)已知:①Fe(s)+| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、X、Y的简单离子半径:r(X2-)<r(Y+) |
| B、M的气态氢化物比N的气态氢化物稳定 |
| C、M与X形成的化合物对应的水化物一定是强酸 |
| D、Y2X和Y2X2中阴、阳离子的个数比相同,但化学键类型不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学面对现代日益严重的环境问题显得无能为力 |
| B、化学将为能源、资源的合理开发和安全应用做出重大贡献 |
| C、化学是一门实用性很强的科学 |
| D、化学是一门以实验为基础的自然科学 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3↓ | ||||
B、用惰性电极电解氯化镁溶液:2Cl-+2H2O
| ||||
| C、将碳与足量的浓硫酸共热反应后的气体混合物,通入过量氢氧化钠溶液中:CO2+SO2+4OH-=SO32+CO32-+2H2O | ||||
| D、84消毒液和洁厕灵混合使用会产生有毒气体:Cl-+ClO-+2H+=Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
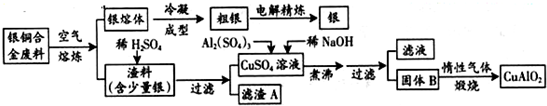
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 钥匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
| 实验用品 | 溶液温度 | 中和热 | |||
| t1 | t2 | △H | |||
| ① | 50 mL 0.55 mol?L-1 NaOH溶液 | 50 mL 0.5 mol?L-1 HCl溶液 | 20℃ | 23.3℃ | |
| ② | 50 mL 0.55 mol?L-1 NaOH溶液 | 50 mL 0.5 mol?L-1 HCl溶液 | 20℃ | 23.5℃ | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com