
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
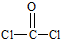 .
.分析 (1)A、B均为短周期金属元素,且B外围最起码有4个电子,并且第二电离到第三电离能突变,所以B是第三周期的镁,由此分析解答;
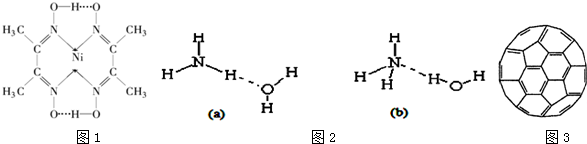
(2)光气(COCl2)各原子最外层都满足8电子稳定结构,C原子与氯原子之间形成C-Cl单键,C原子与O原子之间形成C=O双键,光气分子的结构式是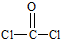 ;(3)根据图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间为氢键;
;(3)根据图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间为氢键;
(4)氨水的电离生成NH4+、OH-,说明NH3•H2O 中O-H键发生断裂,来确定氨水的结构和成键情况;
(5)富勒烯(C60)为分子,其晶体类型为分子晶体;利用均摊法计算每个碳原子参与两个单键的形成,从而计算1mol C60分子中单键的数目.
解答 解:(1)A、B均为短周期金属元素,且B外围最起码有4个电子,并且第二电离到第三电离能突变,所以B是第三周期的镁,镁的基态原子的核外电子排布式1s22s22p63s2,故答案为:1s22s22p63s2;
(2)光气(COCl2)各原子最外层都满足8电子稳定结构,C原子与氯原子之间形成C-Cl单键,C原子与O原子之间形成C=O双键,光气分子的结构式是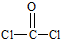 ,故答案为:
,故答案为: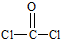 ;
;
(3)根据图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间为氢键,故选:ACE;
(4)NH3溶于水后,形成的NH3•H2O中,NH3•H2O的电离方程式为NH3•H2O?NH4++OH-,可知结构中含有铵根和氢氧根的基本结构,NH3•H2O的合理结构是b,故选:b;
(5)富勒烯(C60)为分子,其晶体类型为分子晶体,每个碳原子参与两个单键的形成,所以1mol C60分子中单键的数目60NA,故答案为:60NA.
点评 本题考查电离能、分子结构、化学键以及分子间作用力等知识,难度不大,应熟练掌握基础知识.


科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度的FeBr2和CuCl2的混合液用惰性电极电解最初发生:Cu2++2Br-═Cu↓+Br2 | |
| B. | H218O中投入Na2O2:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| C. | 向明矾溶液中逐滴加入Ba(OH)2溶液到SO42-恰好沉淀完全: 2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | Fe(NO3)3的酸性溶液中通入足量硫化氢:2Fe3++H2S═2Fe2++S↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用25mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL | |
| B. | 用托盘天平称得25.20g NaCl | |
| C. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| D. | 用10mL量筒量取7.13mL稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
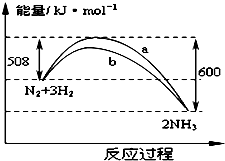 如图是425℃时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
如图是425℃时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92kJ•mol-1 | |
| B. | 一定条件下N2+3H2═2NH3达到平衡时,3v正(H2)=2v逆(NH3) | |
| C. | 加入催化剂,该反应的反应热发生改变 | |
| D. | 温度、容器体积一定,通入1molN2和3molH2反应后放出的热量为Q1kJ,若通入2 molN2和6 molH2反应后放出的热量为Q2kJ,则有184>Q2>2Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com