
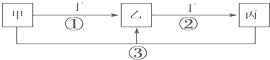
 ��֪�ס��ҡ�����������ѧ��ѧ�ij������ʣ��Ҽס��ҡ���������ͬһ��Ԫ�أ���һ������������֮����ת����ϵ��ͼ��ʾ�����ַ�Ӧ�е�H2O����ȥ����
��֪�ס��ҡ�����������ѧ��ѧ�ij������ʣ��Ҽס��ҡ���������ͬһ��Ԫ�أ���һ������������֮����ת����ϵ��ͼ��ʾ�����ַ�Ӧ�е�H2O����ȥ����
| ||
| ||



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Mg2+ |
| B��Fe2+ |
| C��Fe3+ |
| D��Al3+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A���ܷ���������ԭ��Ӧ��ֻ�Т١��ڡ��ܡ��� |
| B������Ӧ�ٺͷ�Ӧ�۲����������ϣ�������ɫ�����仯 |
| C����Ӧ�����ɵĹ����ڿ����и�������ֻ�����ֽⷴӦ |
| D��������1������3�����ٻ�ϣ��ܼ����������Һ�����ʵ���Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��11.2LNH3�к��е���ԭ����Ϊ1.5NA |
| B��0.2mol/L��NaAlO2��Һ����0.2NA��Al3+ |
| C�����³�ѹ�£�18gˮ��ԭ����Ϊ3NA |
| D��32gO2��O3�Ļ���ﺬ�з�����ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ʵ�����Ħ������ |
| B���û���Ӧ��������ԭ��Ӧ |
| C������������ |
| D�����塢��ɢϵ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
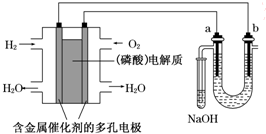 ����������ȼ�ϵ�ص���±ˮ����Cl-��Br-��Na+��Mg2+����װ����ͼ��ʾ��a��bΪʯī�缫��������˵���У���ȷ���ǣ�������
����������ȼ�ϵ�ص���±ˮ����Cl-��Br-��Na+��Mg2+����װ����ͼ��ʾ��a��bΪʯī�缫��������˵���У���ȷ���ǣ�������| A����ع���ʱ��������ӦʽΪ��O2+2H2O+4e-�T4OH- |
| B�����ʱ��a�缫��Χ���ȷŵ����Br-������Cl-��˵��������������ͬʱǰ�ߵĻ�ԭ��ǿ�ں��� |
| C�����ʱ����������·���ǣ����������·����������Һ������������ |
| D������������ģ������������0.2 g H2ʱ��b����Χ�����2.24L H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
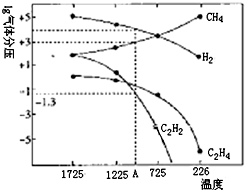 ��Ȳ��C2H2��������������л��ϳ�����;�dz��㷺�����ɵ�ʯ��CaC2��ֱ��ˮ�����������1500�����������ѽⷨ������
��Ȳ��C2H2��������������л��ϳ�����;�dz��㷺�����ɵ�ʯ��CaC2��ֱ��ˮ�����������1500�����������ѽⷨ�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
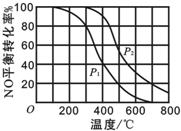
| A��p2��p1��Q��0 |
| B��p2��p1��Q��0 |
| C��p2��p1��Q��0 |
| D��p2��p1��Q��0 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com