
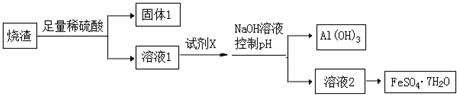
分析 硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)中加入足量稀硫酸,发生的反应有Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Al2O3+3H2SO4=Al2(SO4)3+3H2O,SiO2不溶于稀硫酸,然后过滤,得到的固体1成分为SiO2,滤液1中含有Fe2(SO4)3、H2O、Al2(SO4)3;在滤液1中加入X,然后加入NaOH溶液并调节溶液的pH,得到沉淀Al(OH)3 和溶液2,从溶液2中能得到FeSO4•7H2O晶体,说明溶液2中溶质为FeSO4,则X具有还原性,能将Fe3+氧化为Fe2+,且不能引进新的杂质,则X为Fe,加入试剂X发生的离子反应有2 Fe3++Fe=3Fe2+、Fe+2H+=Fe2++H2↑,将溶液2蒸发浓缩、冷却结晶、过滤得到FeSO4•7H2O晶体,据此分析解答.
解答 解:硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)中加入足量稀硫酸,发生的反应有Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Al2O3+3H2SO4=Al2(SO4)3+3H2O,SiO2不溶于稀硫酸,然后过滤,得到的固体1成分为SiO2,滤液1中含有Fe2(SO4)3、H2O、Al2(SO4)3;在滤液1中加入X,然后加入NaOH溶液并调节溶液的pH,得到沉淀Al(OH)3 和溶液2,从溶液2中能得到FeSO4•7H2O晶体,说明溶液2中溶质为FeSO4,则X具有还原性,能将Fe3+氧化为Fe2+,且不能引进新的杂质,则X为Fe,加入试剂X发生的离子反应有2 Fe3++Fe=3Fe2+、Fe+2H+=Fe2++H2↑,将溶液2蒸发浓缩、冷却结晶、过滤得到FeSO4•7H2O晶体,
(1)通过以上分析知,固体1为难溶于稀硫酸的SiO2,故答案为:SiO2;
(2)通过以上分析知,X为Fe,试剂X与溶液1发生的离子反应为2 Fe3++Fe=3Fe2+、Fe+2H+=Fe2++H2↑,
故答案为:Fe;2 Fe3++Fe=3Fe2+、Fe+2H+=Fe2++H2↑;
(3)从溶液中获取晶体的操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:冷却结晶;过滤.
点评 本题考查物质分离和提纯,为高频考点,侧重考查学生分析推断及基本操作能力,明确物质性质及流程图中可能发生的反应、基本操作方法是解本题关键,注意X与溶液1的反应中还有稀硫酸与Fe的反应,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
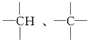 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示,则烷烃(除甲烷外)中存在的关系有:(用以上符号回答)
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示,则烷烃(除甲烷外)中存在的关系有:(用以上符号回答)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K值不变,平衡一定不移动 | B. | K值变化,平衡一定移动 | ||
| C. | 平衡移动,K值一定变化 | D. | 平衡移动,K值一定不变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
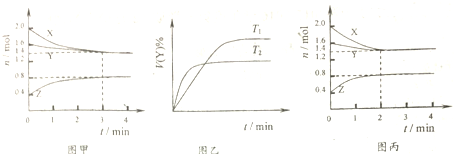
| A. | T1℃时,容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g),且正反应放热 | |
| B. | T1℃时,反应进行的前3min内,用X表示的反应速率v(X)=0.2mol•(L•min)-1 | |
| C. | T1℃时,3min达到平衡后,向容器中再加入2.0mol X、1.6mol Y、0.4mol Z,反应达到新平衡时:0.7mol•L-1<c(Y)<1.4mol•L-1 | |
| D. | 若改变反应条件,使反应进程如图丙所示,则改变的条件是使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
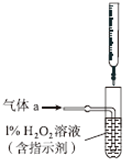 硫酸工业产生的废气(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境.某化学兴趣小组对废气的组成进行探究,请回答下列问题:
硫酸工业产生的废气(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境.某化学兴趣小组对废气的组成进行探究,请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步骤 | 操作 | 现象及结论 |
| 1 | 用甲、乙两支试管分别取两种溶液各少许. | |
| 2 | 用胶头滴管向甲试管中逐滴滴加BaCl2溶液至过量. | |
| 3 | 静置,将甲中上层清液注入乙中 | 若产生白色沉淀,则甲是Na2SO3溶液,乙是稀H2SO4. 若乙试管中沉淀溶解且放出有刺激性气味的气体,则甲是稀H2SO4,乙是Na2SO3溶液. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com