
【题目】NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如图:
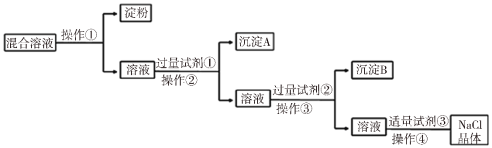
(1)操作①是利用半透膜进行分离提纯。
操作①的实验结果:淀粉___(填“能”或“不能”)透过半透膜;SO42-___(填“能”或“不能”)透过半透膜。
(2)写出实验过程中所用试剂(写化学式):
试剂①___;试剂③___。
(3)判断试剂①已过量的方法是:___。
(4)用离子方程式表示加入试剂②的作用:Ba2++CO32-=BaCO3↓、___。
【答案】不能 能 BaCl2 HCl 静置,向上层清液中滴加少量氯化钡溶液,无白色沉淀产生,说明氯化钡溶液已过量 Ca2++CO32-=CaCO3↓
【解析】
胶体不能透过半透膜,操作①为渗析;除去Na2SO4、CaCl2,可分别加入BaCl2、Na2CO3,由于所加除杂试剂是过量的,所以先加入过量BaCl2,除去硫酸根离子;再加入过量Na2CO3(除去钙离子和过量的钡离子),则试剂①为BaCl2,操作②为过滤,沉淀A为硫酸钡,试剂②为Na2CO3,操作③为过滤,沉淀B为碳酸钙和碳酸钡;试剂③为盐酸,加入盐酸可除去过量的Na2CO3,最后蒸发结晶可得到NaCl晶体,以此解答该题。
(1)胶体粒子和浊液粒子半径比较大,不能透过半透膜,而溶质粒子可通过半透膜,故淀粉不能透过半透膜;SO42-能透过半透膜;
(2)由以上分析可知试剂①为BaCl2,试剂③为HCl;
(3)判断试剂①已过量的方法是静置,向上层清液中滴加少量氯化钡溶液,无白色沉淀产生,说明氯化钡溶液已过量;
(4)试剂②为Na2CO3,加入试剂②的作用是除去溶液中钙离子和过量的钡离子,反应的离子方程式为Ba2++CO32-=BaCO3↓、Ca2++CO32-=CaCO3↓。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的数值,下列说法中正确的是
表示阿伏加德罗常数的数值,下列说法中正确的是
A. 在常温常压下,11.2L氯气所含的原子数为![]()
B. 2.3g金属钠被氧化成Na2O2,转移电子数为0.1![]()
C. 5.6g铁与足量稀盐酸反应转移的电子数为0.3![]()
D. 2L 0.1 mol/LNa2SO4溶液中含有的Na+的数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的化工原料,以乙烯为原料在不同条件下可合成下列物质(部分条件未标出):

(1)乙醇能与乙酸反应生成有果香味的物质,其名称为__________,该反应类型是____________
(2)反应⑥的化学方程式是______________实验现象是__________________
(3)反应③用KOH的乙醇溶液处理二氯乙烷制氯乙烯的方程式为:____________
(4)苯乙烯中所含官能团的名称_____________
(5)苯乙烯合成聚苯乙烯的化学方程式是_____________________
(6)以乙醇和苯乙烯为原料合成有机物![]() ,写出合成路线图_________________。
,写出合成路线图_________________。
(合成路线常用的表示方法为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡:CH3COOH![]() H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.1 mol/L的醋酸溶液加水稀释,溶液中c(OH-)减小
C.醋酸溶液中加入少量CH3COONa固体,平衡逆向移动
D.常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:3A(气)![]() 3B(?)+C(?);△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是 ( )
3B(?)+C(?);△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是 ( )
A. B和C可能都是固体B. B和C一定都是气体
C. 若C为气体,则B一定是固体D. B和C可能都是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,22.4LHCl气体溶于水,制成250mL溶液,所得溶液中氯化氢物质的量浓度为_____;若将该盐酸再稀释成1L溶液A,则其氯化氢的物质的量浓度变为_________;
(2)从A溶液取出250mL盐酸与足量Zn反应,在标准状况下可生成多少体积的气体?(根据化学方程式计算)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)有下列几组物质或原子:①612C和614C②H③Na2O2④P⑤N⑥H2⑦O2和O3⑧烧碱、纯碱及苛性钠。选择适当的序号回答有关问题:
(1)属于第二周期ⅤA族的元素是_____________;
(2)含有非极性键的离子化合物是_____________;
(3)互为同位素的是_____________;
(4)原子半径最小的原子形成的分子是_____________;
(5)属于同素异形体的是_____________。
(II)用合理的化学用语回答下列问题
(1)甲烷分子的电子式:_____________;
(2)乙烯分子的结构简式:_____________;
(3)甲烷和氯气光照生成一氯甲烷方程式:_____________;
(4)苯和液溴在铁屑催化下反应生成溴苯方程式:_____________;
(5)乙醇和金属钠反应生成乙醇钠方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶性显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料,也是一种半导体材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。请回答:
(1)Y在元素周期表中的位置是________。
(2)Y的最高氧化物相应水化物具有______(填“酸性”、“碱性”、“两性”)。并写出其电离方程式______。
(3)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈__性(填“酸”、“碱”或“中”),用离子方程式表示其原因是__。
(4)Z和W比较,非金属性较弱的是_______(填元素符号)。下列可以验证这一结论的是_______(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.氢化物的水溶性
d.Z与W以共价键形成化合物时,Z或W显示的化合价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com