
| A. | 1:1 | B. | 3:4 | C. | 4:3 | D. | 9:8 |
分析 铝粉和四氧化三铁配成的铝热剂,分成两等份,设每份都含有1molAl;
一份在高温下恰好反应完全,实质为铝置换出铁,根据铝计算出铁,再根据铁与足量稀硫酸反应,计算生成的氢气的物质的量;另一份直接放入足量的烧碱溶液中,只有铝与氢氧化钠发生反应生成氢气,根据铝的物质的量计算生成氢气的物质的量;利用相同条件下,体积之比等于物质的量之比计算a:b.
解答 解:四氧化三铁中铁元素的化合价为+$\frac{8}{3}$,设每份都含有1molAl,
对于在高温下恰好完全反应,再与足量稀硫酸反应,根据电子守恒可得关系式:
9Al~8Fe~8H2
8 9 8
1mol $\frac{9}{8}$mol $\frac{9}{8}$mol
对于直接放入足量的烧碱溶液中,根据电子守恒可得
2Al~3H2
2 3
1mol 1.5mol
相同条件下,体积之比等于物质的量之比,所以a:b=$\frac{9}{8}$mol:1.5mol=3:4,
故选B.
点评 本题考查混合物的计算,题目难度中等,明确发生反应实质为解答关键,注意掌握电子守恒、关系式法在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
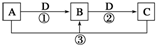 已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 己烷(己烯):加入溴水,分液 | B. | 硝酸钾(氯化钠):浓溶液降温结晶 | ||
| C. | Fe3+(Al3+)):过量的氨水,过滤 | D. | CO2(CO):点燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44.8 L氟化氢气体分解成22.4 L的氢气和22.4 L的氟气吸收546.6 kJ热量 | |
| B. | 1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量大于546.6 kJ | |
| C. | 相同条件下,1 mol氢气与1 mol氟气的能量总和高于2 mol氟化氢气体的能量 | |
| D. | 2 mol H-F键的键能比1 mol H-H键和1 mol F-F 键的键能之和大546.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫不能使溴水、高锰酸钾溶液迅速褪色 | |
| B. | 接触法制硫酸的沸腾炉排出的炉气中含SO2 | |
| C. | 实验室可用启普发生器制取二氧化硫 | |
| D. | 用石灰水很容易区分二氧化碳和二氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为:2H+-2e-═H2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 钢铁发生电化学腐蚀的负极反应式:Fe-2e-═Fe2+ | |
| D. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com