
【题目】A、B、C、D、E的原子序数依次增大,其中E不属于短周期元素,常见单质分子B2中含有3对共用电子对,D的最外层电子数是周期序数的2倍,E单质是一种紫红色金属,甲、乙、丙是上述部分元素组成的二元化合物.且乙、丙分子所含电子总数相同,转化关系如图所示,其中甲是黑色固体,丙是一种常见的无色液体。下列说法不正确的是
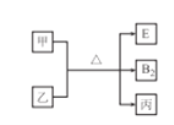
A. 乙分子中共用电子对数目与B2分子相同
B. 单质D与E在加热时可生成1:1型化合物
C. 原子半径:B>C
D. C与D位于同一主族,与B位于同一周期
【答案】B
【解析】A、B、C、D、E的原子序数依次增大,单质分子B2中含有3对共用电子对,B为N元素;D的最外层电子数是周期序数的2倍,D为S元素;E不属于短周期元素,E单质是一种紫红色金属,E为Cu元素;其中甲、乙、丙是上述部分元素组成的二元化合物。丙是一种常见的无色液体,丙为水,则A为H元素,C为O元素;甲是黑色固体,甲为CuO;乙、丙分子所含电子总数相同,则乙也含有10个电子,乙为NH3。A. 氨气分子中共用电子对数目与N2分子相同,均为3个,故A正确;B. S与Cu反应生成Cu2S,属于2:1型化合物,故B错误;C. 同一周期,自左而右,原子半径逐渐减小,同一主族自上而下,原子半径逐渐增大,原子半径:N>O,故C正确;D. O与S均位于ⅥA族,O与N均位于第2周期,故D正确;故选B。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法不正确的是
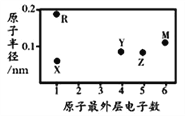
A. 简单阳离子半径:X
B. M的氢化物常温常压下为气体,分子间无氢键
C. 最高价氧化物的水化物的酸性:Z<Y
D. X与Y可以形成平面形结构的分子,分子中存在极性共价键和非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质]
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为 ________ ,结构中有 ___ 种不同形状的电子云。
(2)MgO的熔点高于CuO的原因是__________________________
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是_____________________
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为 _____________________
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为______ ,BF4-的空间构型为_________________ 。
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为 ____________,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数为 _______________ cm(列出计算式即可)。
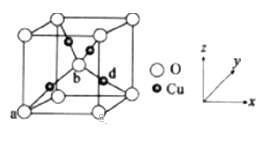
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或事故处理正确的是( )
A.利用溶于水后“过滤”操作能分离NaCl和Ba(OH)2
B.实验结束后,用嘴吹灭酒精灯
C.皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗
D.稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g) △H1=-90.8 kJ/mol。
已知:2H2(g)+O2(g)=2H2O(1) △H2=-571.6 kJ/mol
H2(g)+![]() O2(g)=H2O(g) △H3=-241.8 kJ/mol
O2(g)=H2O(g) △H3=-241.8 kJ/mol
下列有关说法正确的是
A. H2的燃烧热为241. 8 kJ/mol
B. CH3OH(g)+O2(g)=CO(g)+2H2O(g) △H=-392. 8 kJ/mol
C. “![]() ”既表示分子个数也能表示物质的量
”既表示分子个数也能表示物质的量
D. 未注明温度和压强时,△H表示标准状况下的数据
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中_____区元素,其基态原子的价电子排布式为_____。
(2)基态Na原子中,核外电子占据的原子轨道总数为____,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为_____(用元素符号表示)。
(4)CO32-的几何构型为______;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为_________,1mol碳酸丙烯酯中键的数目为________.

(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是_____,该配离子包含的作用力为__(填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______,该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为_____cm(用含ρ、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.复分解反应一定不是氧化还原反应
B.置换反应一定是氧化还原反应
C.有单质参加的化合反应一定是氧化还原反应
D.没有单质生成的分解反应一定不是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应: ![]() +
+ ![]()
![]()
![]() 如果要合成化合物A,其结构为:
如果要合成化合物A,其结构为: ![]() 下列说法不正确的是( )
下列说法不正确的是( )
A.化合物A和HBr 按照物质的量1:1加成时,有三种不同的产物
B.该反应的原理是加成反应
C.合成A的原料可能是:丙炔和2,3﹣二甲基﹣1,3﹣丁二烯
D.合成A的原料可能是:2﹣丁炔和2﹣甲基﹣1,3﹣丁二烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com