
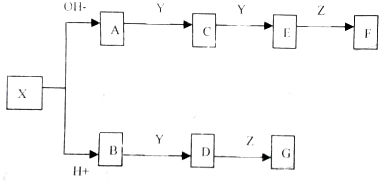
| A���������������ȷ�Ӧ���ɽ����¶ȣ��ӳ���㱣���� |
| B����������������ԭ��ظ������缫��ӦΪ��Fe-3e-=Fe3+ |
| C������������̼��ԭ����������缫��ӦΪ��2H2O+O2+4e-=4OH - |
| D������1.12 g���۵����������������������������224 mL����״���� |
| ||
| 4 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
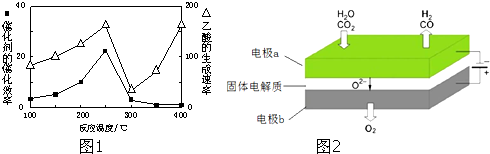
| ��һ������ | ���Ӱ뾶 | �е� |
| Na | O2- | CH4 |
| �� �� | CH4 | CO2 | CO | H2 |
| ������� | 0.1 | 0.1 | 0.4 | 0.4 |
| ||
| ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������������� |
| B�������ο������Ƶ��� |
| C�����������¿�ʢװ�ȡ�Ũ���� |
| D�������ƿ�������ľ�ķ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
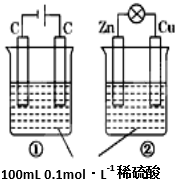
| ѡ�� | ���� | ���� |
| A | װ�����ƣ����ǵ��أ�����ԭ��� | ���� |
| B | ����Ũ�ȱ仯�������ڼ�С | ��ȷ |
| C | �缫��Ӧʽ������������4OH--4e-�T2H2O+O2�� ����������Zn-2e-�TZn2+ | ��ȷ |
| D | �����ƶ�������H+�����������ƶ� ����H+�����������ƶ� | ���� |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��
| ||
B��
| ||
C��
| ||
D��
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
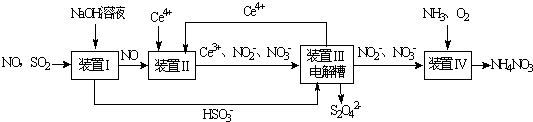
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
| A������ˮ�м���NaHCO3������������ˮ�д������Ũ�� |
| B��������Һ�У�ˮ�ĵ���̶�������NaClO |
| C�������£���ͬ���ʵ���Ũ�ȵ�H2SO3��H2CO3��HClO��pH������H2SO3 |
| D��NaHSO3��Һ������Ũ�ȴ�С˳��Ϊc��Na+����c��H+����c��HSO3-����c��SO32-����c��OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� ��ͼװ��������ⱥ��ʳ��ˮ��C�缫������������ʹʪ��ĵ���KI��ֽ���� |
B��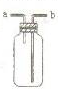 ��ͼװ�ÿ������ռ�H2��NH3��Cl2��HCl��NO2 |
C�� ��ͼװ����XΪ�������������յ��������� |
D��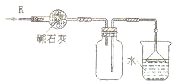 ��ͼװ�ÿ����ڸ���ռ������������ն���İ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com