
【题目】某烯烃与氢气加成后得到2,2-二甲基丁烷,则该烯烃的名称是
A. 2,2-二甲基-3-丁烯 B. 2,2-二甲基-2-丁烯
C. 2,2-二甲基-1-丁烯 D. 3,3-二甲基-1-丁烯
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下有:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3。下列对这四种气体的描述正确的是( )
a. 体积②>③>①>④ b. 密度②>③>④>①
c. 质量②>③>①>④ d. 氢原子个数①>③>④>②
A. abc B. bcd C. abd D. abcd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中,利用相关实验器材(规格和数量不限)能够完成相应实验的是
选项 | 实验器材 | 相应实验 |
A | 探究化学反应的限度 | 取5mL0.1mol/LKI溶液,滴加0.1mol/L FeCl3溶液5~6滴,可根据溶液中既含I2又含有I-的实验事实判断该反应是可逆反应 |
B | 探究酸性:HCO 3 ->Al(OH) 3 | 向NaHCO3溶液中滴加NaAlO2溶液,观察是否有白色沉淀产生 |
C | 探究浓度对化学反应速率的影响 | 用两只试管各取5mL0.1mol/LKMnO4溶液,分别加入2mL0.1mol/L和1mL0.2mol/LH 2C 2O 4溶液,记录溶液褪色所需要的时间 |
D | 探究氧化性:Cl 2>Br 2>I2 | 向NaBr溶液中滴加氯水,再加入淀粉KI溶液,溶液变蓝 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯分子中C—C之间形成一个σ键和一个π键;乙炔分子C—C之间形成一个σ键和2个π键。根据所学理论,写出:
(1)在乙烯和乙炔分子与溴发生加成反应中,断裂何种类型键?____________
(2)写出加成反应方程式。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,如图所示。
物质 | 燃烧热(kJ/mol) |
氢气 | 285.8 |
甲烷 | 890.3 |
乙烯 | 1411.5 |
(1)已知相关物质的燃烧热如上表,写出甲烷制备乙烯的热化学方程式_________。
(2)在400℃时,向1L的恒容反应器中充入1molCH4,发生上述反应,测得平衡混合气体中C2H4的体积分数为20.0 %。则在该温度下,其平衡常数K=_______。按化学平衡移动原理,在图(a)中画出该反应的平衡转化率与温度及压强(p1>p2)的关系曲线。_______________________
(3)在制备C2H4时,通常存在副反应:2CH4(g)![]() C2H6(g)+H2(g)。在常温下,向体积为1L的恒容反应器中充入1molCH4,然后不断升高温度,得到图(b)。
C2H6(g)+H2(g)。在常温下,向体积为1L的恒容反应器中充入1molCH4,然后不断升高温度,得到图(b)。
①在200℃时,测出乙烷的量比乙烯多的主要原因是_________________________。
②在600℃后,乙烯的体积分数减少的主要原因是__________________________。

(4)工业上常采用除杂效率高的吸收-电解联合法,除去天然气中的杂质气体H2S,并转化为可回收利用的单质硫,其装置如下图所示。

通电前,先通入一段时间含H2S的甲烷气,使部分NaOH吸收H2S转化为Na2S,再接通电源,继续通入含杂质的甲烷气,并控制好通气速率。装置中右端碳棒为_________极,左端碳棒上的电极反应为_________________________,右池中的c(NaOH):c(Na2S)______________(填“增大”、“基本不变”或“减小)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“垃圾是放错了位置的资源”,应该分类回收。生活中废弃的铁锅、铝质易拉罐、钢导线等可以归为一类加以回收,它们属于( )
A.有机物
B.金属或合金
C.氧化物
D.盐
查看答案和解析>>
科目:高中化学 来源: 题型:
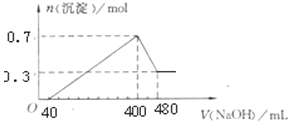
【题目】A.将一定质量的Mg和Al混合物投入400 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。
计算:
(1)Mg和Al的总质量为________g;
(2)硫酸的物质的量浓度为________;
(3)生成H2的物质的量为________。
B.将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL ,4mol/L的稀硫酸中,生成标准状况下6.72L气体。向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:
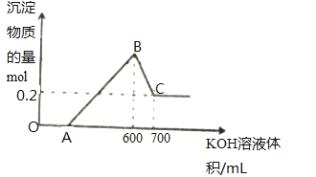
(1)OA对应反应的离子方程式为_________,BC对应反应的离子方程式为____________;
(2)c(KOH)=_________mol/L,混合物中氧化铝的物质的量为_____mol;
(3)A点对应的数值为_______;
(4)在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是___________。
(5)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com