
1840年,俄国化学家盖斯从大量实验事实中总结出了一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,放出XkJ热量。已知单质碳的燃烧热为YkJ/mol,则1mol C与O2反应生成CO的反应热ΔH为 ( )
A.-YkJ/mol B.-(10X-Y)kJ/mol
C.-(5X-0.5Y)kJ/mol D.+(10X-Y)kJ/mol
科目:高中化学 来源: 题型:
在无土栽培中,配制一定量的营养液,使其中含有50 mol NH4Cl、16 mol KCl和24 mol K2SO4,若改用KCl、NH4Cl、(NH4)2SO4三种固体为原料配制,三者的物质的量依次是(单位为mol)( )
A.2、64、24 B.64、2、24 C.30、50、12 D.16、50、24
查看答案和解析>>
科目:高中化学 来源: 题型:
CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以提高尾气处理效果的是 ( )。
①选用适当的催化剂 ②提高装置温度 ③降低装置的压强 ④装置中放入碱石灰
A.①③ B.②④
C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解400 mL一定浓度的硫酸铜溶液(不考虑电解过程中溶液体积的变化),通电一段时间后,如果向所得的溶液中加入0.05 mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和体积(不考虑CO2的溶解),电解过程中转移的电子物质的量为( )
A.0.2 mol
B. 0.3mol
C. 0.4 mol
D. 0.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示是根据图甲的电解池进行电解时某个量(纵坐标x)随时间变化的函数图像(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),这个量x是表示( )
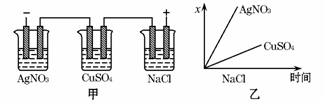 A.各电解池析出气体的体积
A.各电解池析出气体的体积
B.各电解池阳极质量的增加量
C.各电解池阴极质量的增加量
D.各电极上放电的离子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
Harbermann等设计出利用Desulfovibrio desulfurcan菌种生成的硫化物作为介体的微生物燃料电池,电池内部有质子通过,该系统不经任何维护可连续运行5年。该电池的负极反应式为S2-+4H2O-8e-===SO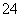 +8H+。有关该电池的下列说法中正确的是 ( )。
+8H+。有关该电池的下列说法中正确的是 ( )。
A.若有1.12 L氧气参与反应,则有0.2 mol电子发生转移
B.质子由正极移向负极
C.该电池的总反应为S2-+2O2===SO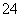
D.正极的电极反应式为2O2+8e-+4H2O===8OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)请写出元素N的基态原子电子排布式:____________________________。
(2)元素B、G形成的单质熔点更高的是________(填化学式),原因是________
________________________________________________________________。
(3)ME2L2常温下为深红色液体,能与 CCl4、CS2 等互溶,据此可判断 ME2L2 是________(填“极性”或“非极性”)分子。根据等电子原理:NO 中氮原子的杂化类型是________;1 mol NO
中氮原子的杂化类型是________;1 mol NO 中含有 π 键的数目为__________。
中含有 π 键的数目为__________。
(4)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有________(填序号),CS2分子的立体构型是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com