
| A. | 磷酸的摩尔质量与6.02×1023个硫酸分子的质量在数值上相等 | |
| B. | 6.02×1023个氮分子和6.02×l023个氢分子的质量比等于14:1 | |
| C. | 32g氧气所含的原子数目约为1.204×1024 | |
| D. | O2、SO2、SO3三者的质量比为2:4:5时,它们的物质的量之比为2:2:3 |
分析 A.6.02×1023个硫酸分子的物质的量为1mol,利用m=nM来比较两数值的大小进行判断;
B.根据m(N2):m(H2)=n(N2)M(N2):n(H2)M(N2)=$\frac{N({N}_{2})×M({N}_{2}):}{{N}_{A}}$:$\frac{N({H}_{2})×M({H}_{2})}{{N}_{A}}$判断;
C.每个氧分子中含2个原子,根据N(O)=2×$\frac{m({O}_{2})}{M({O}_{2})}$NA计算判断;
D.根据n=$\frac{m}{M}$可知物质的物质的量,再计算它们的物质的量之比.
解答 解:A.6.02×1023个硫酸分子的物质的量为1mol,其质量为98g,硫酸的摩尔质量为98g/mol,所以磷酸的摩尔质量与NA个硫酸分子的质量在数值上相等,故A正确;B.m(N2):m(H2)=n(N2)M(N2):n(H2)M(N2)=$\frac{N({N}_{2})×M({N}_{2}):}{{N}_{A}}$:$\frac{N({H}_{2})×M({H}_{2})}{{N}_{A}}$=M(N2):M(H2)=28g/mol:2g/mol=14:1,故B正确;
C.每个氧分子中含2个原子,根据N(O)=2×$\frac{m({O}_{2})}{M({O}_{2})}$NA=2×$\frac{32g}{32g/mol}$×NA=2×6.02×1023=1.204×1024,故C正确;
D.O2、SO2、SO3三者的质量比为2:4:5,O2、SO2、SO3三者的摩尔质量分别为32g/mol、64g/mol、80g/mol,由n=$\frac{m}{M}$可知,它们的物质的量之比为$\frac{2}{32}$:$\frac{4}{64}$:$\frac{5}{80}$=1:1:1,故D错误;
故选D.
点评 本题考查了物质的量的有关计算、阿伏伽德罗常数的有关计算,题目难度不大,明确质量、物质的量、摩尔质量的关系,注意气体摩尔体积的使用范围和使用条件是解答关键.


科目:高中化学 来源: 题型:选择题
| A. | 先加足量的KMnO4酸性溶液,然后再加入溴水 | |
| B. | 先加足量溴水,然后再加入KMnO4酸性溶液 | |
| C. | 点燃这种液体,然后再观察火焰的颜色 | |
| D. | 加入浓硫酸与浓硝酸后加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,说明一定含有SO${\;}_{4}^{2-}$ | |
| B. | 向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,同时有气体逸出,说明一定存在CO32-和AlO${\;}_{2}^{-}$ | |
| C. | 用焰色反应检验时,透过蓝色钴玻璃观察火焰呈紫色,则说明含有K+没有Na+ | |
| D. | 取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12,说明不存在NH${\;}_{4}^{+}$、Al3+、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CHOHCOOH | B. | HO(CH2)2CHO | C. | HOOC-COOH | D. | CH3CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


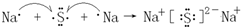 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com