

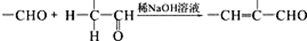 ;
; 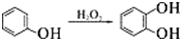
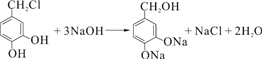 .
. +2Ag(NH3)2OH$\stackrel{水浴}{→}$
+2Ag(NH3)2OH$\stackrel{水浴}{→}$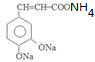 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. (任三种).
(任三种).分析 咖啡酸的相对分子质量为90×2=180,n(O)=(180×35.6%)÷16=4,咖啡酸可与NaHCO3溶液反应生成气体,说明含有羧基-COOH;1 mol咖啡酸与足量钠反应生成1.5mol H2,则说明一共含有3个羟基-OH.结合含氧数目及羧基,则应该有1个羧基和2个羟基,分子中C、H总相对原子质量为180-16×4=116,分子中碳原子最大数目为$\frac{112}{12}$=9…4,结合转化关系与反应信息可知,咖啡酸的分子式为C9H8O4.则A为 ,因为B的核磁共振氢谱有三个波峰,说明有三种氢原子,氯原子在苯环上甲基的对位上,故B为
,因为B的核磁共振氢谱有三个波峰,说明有三种氢原子,氯原子在苯环上甲基的对位上,故B为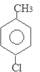 ,B在NaOH的水溶液中发生反应产生
,B在NaOH的水溶液中发生反应产生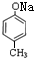 ,酸化后产生C为
,酸化后产生C为 ,对甲基苯酚被H2O2氧化生成D为
,对甲基苯酚被H2O2氧化生成D为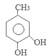 ,D在氯气存在时光照发生取代反应产生E为
,D在氯气存在时光照发生取代反应产生E为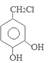 ,E在加热时与氢氧化钠溶液发生反应产生F为
,E在加热时与氢氧化钠溶液发生反应产生F为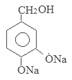 ,F在催化剂存在时加热得到G为
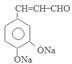
,F在催化剂存在时加热得到G为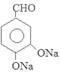 .G与CH3CHO在NaOH溶液中加热发生反应得到H为
.G与CH3CHO在NaOH溶液中加热发生反应得到H为 .H与银氨溶液水浴加热反应产生I为
.H与银氨溶液水浴加热反应产生I为 .I酸化得到咖啡酸为
.I酸化得到咖啡酸为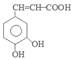 .咖啡酸与苯乙醇发生酯化反应得到J为咖啡酸苯乙酯,结构简式为:
.咖啡酸与苯乙醇发生酯化反应得到J为咖啡酸苯乙酯,结构简式为: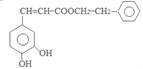 .咖啡酸苯乙酯在一定条件下发生加聚反应产生高聚物聚咖啡酸苯乙酯
.咖啡酸苯乙酯在一定条件下发生加聚反应产生高聚物聚咖啡酸苯乙酯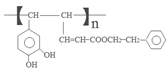 ,据此解答.
,据此解答.
解答 解:咖啡酸的相对分子质量为90×2=180,n(O)=(180×35.6%)÷16=4,咖啡酸可与NaHCO3溶液反应生成气体,说明含有羧基-COOH;1 mol咖啡酸与足量钠反应生成1.5mol H2,则说明一共含有3个羟基-OH.结合含氧数目及羧基,则应该有1个羧基和2个羟基,分子中C、H总相对原子质量为180-16×4=116,分子中碳原子最大数目为$\frac{112}{12}$=9…4,结合转化关系与反应信息可知,咖啡酸的分子式为C9H8O4.则A为 ,因为B的核磁共振氢谱有三个波峰,说明有三种氢原子,氯原子在苯环上甲基的对位上,故B为
,因为B的核磁共振氢谱有三个波峰,说明有三种氢原子,氯原子在苯环上甲基的对位上,故B为 ,B在NaOH的水溶液中发生反应产生
,B在NaOH的水溶液中发生反应产生 ,酸化后产生C为
,酸化后产生C为 ,对甲基苯酚被H2O2氧化生成D为
,对甲基苯酚被H2O2氧化生成D为 ,D在氯气存在时光照发生取代反应产生E为
,D在氯气存在时光照发生取代反应产生E为 ,E在加热时与氢氧化钠溶液发生反应产生F为
,E在加热时与氢氧化钠溶液发生反应产生F为 ,F在催化剂存在时加热得到G为
,F在催化剂存在时加热得到G为 .G与CH3CHO在NaOH溶液中加热发生反应得到H为
.G与CH3CHO在NaOH溶液中加热发生反应得到H为 .H与银氨溶液水浴加热反应产生I为
.H与银氨溶液水浴加热反应产生I为 .I酸化得到咖啡酸为
.I酸化得到咖啡酸为 .咖啡酸与苯乙醇发生酯化反应得到J为咖啡酸苯乙酯,结构简式为:
.咖啡酸与苯乙醇发生酯化反应得到J为咖啡酸苯乙酯,结构简式为: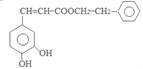 .咖啡酸苯乙酯在一定条件下发生加聚反应产生高聚物聚咖啡酸苯乙酯
.咖啡酸苯乙酯在一定条件下发生加聚反应产生高聚物聚咖啡酸苯乙酯 ,
,
(1)由上述分析可知,咖啡酸的分子式为C9H8O4,结构简式为 ,所有含氧官能团的名称:羧基、羟基,
,所有含氧官能团的名称:羧基、羟基,
故答案为:C9H8O4;羧基、羟基;
(3)反应④属于氧化反应,反应⑧属于加聚反应,故答案为:氧化反应;加聚反应;
(4)反应③的化学方程式: ,故答案为:
,故答案为: ;
;
(4)反应⑥为 发生银镜反应,反应的化学方程式为
发生银镜反应,反应的化学方程式为 +2Ag(NH3)2OH$\stackrel{水浴}{→}$
+2Ag(NH3)2OH$\stackrel{水浴}{→}$ +2Ag↓+3NH3+H2O,
+2Ag↓+3NH3+H2O,
故答案为: +2Ag(NH3)2OH$\stackrel{水浴}{→}$
+2Ag(NH3)2OH$\stackrel{水浴}{→}$ +2Ag↓+3NH3+H2O;
+2Ag↓+3NH3+H2O;
(5)满足条件①含有两个羧基 ②苯环上有三个取代基的咖啡酸的同分异构体有: ,共6种,
,共6种,
故答案为:6; (任三种).
(任三种).
点评 本题考查有机物推断与合成,利用正、逆推法相结合进行推断,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氯气和水的反应 Cl2+H2O═2H++Cl-+ClO- | |
| B. | 碳酸氢钠水解 HCO3-+H2O═H3O++CO32- | |
| C. | 碳酸钠水解 CO32-+2H2O═H2CO3+2OH- | |
| D. | 亚硫酸氢钠与过量的Ba(OH)2溶液 HSO3-+Ba2++OH-═BaSO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①④⑥ | C. | ①②⑥ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极附近的SO42-浓度逐渐增大 | B. | 电子通过导线由铜片流向锌片 | ||
| C. | 正极有O2逸出 | D. | 铜片上有H2逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 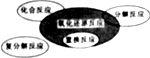 四种基本反应类型有氧化还原反应的关系 | |
| B. | 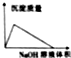 AlCl3溶液中滴加NaOH溶液生成沉淀的情况 | |
| C. | 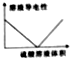 Ba(OH)2溶液中滴加硫酸溶液时的导电性情况 | |
| D. |  等体积、等浓度的稀硫酸分别与足量的铁和镁反应的情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一个分子O4由两个分子O2构成 | |
| B. | O4是一种单质 | |
| C. | 等体积的O4和O2含有相同数目的分子 | |
| D. | 等质量的O4和O2含有相同数目的氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
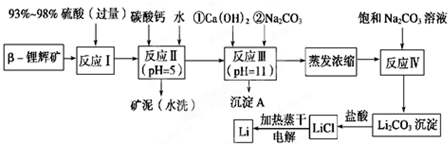
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com