
【题目】据了解,铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈(形成了保护层)和有害锈(使器物损坏程度逐步加剧,并不断扩散),结构如图所示。
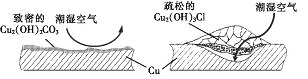
下列说法正确的是
A. Cu2(OH)3Cl属于有害锈
B. Cu2(OH)2CO3属于复盐
C. 青铜器表面刷一层食盐水可以做保护层
D. 用NaOH溶液法除锈可以保护青铜器的艺术价值,做到“修旧如旧”
科目:高中化学 来源: 题型:
【题目】2018年11月,河南省环境监测中心基于卫星遥感数据共监测到秸秆焚烧火点 29个,秸秆燃烧后的草木灰的主要成分是碳酸押,还含有少量的硫酸钾,氯化钾和部分难溶物。某实验中学对秸秆燃烧后的草木灰中的成分进行了探究。

(1)上述流程中操作II为_____(填“过滤”或“分液"),操作Ⅲ中需要使用玻璃棒,其作用为_____。
(2)白色沉淀中所含物质的化学式:________。写出生成此沉淀的化学方程式:_____;____。
(3)下列关于洁秆燃烧的说法不合理的是______
A.焚烧粘秆极易引燃周围的易燃物从而引发火灾
B.焚烧秸秆形成的烟雾,会造成空气能见度下降,进而引发交通事故,影响道路交通和航空安全
C.秸杆燃烧会产生钾肥,可以广泛推广,大力支持就地焚烧秸秆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.6g H2O的物质的量是______,含有______个水分子,含有______mol H;12.4gNa2R含Na+0.4mol,则Na2R的摩尔质量为______,R的相对原子质量为______。含R的质量为1.6g的Na2R,其物质的量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
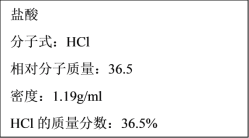
(1)该浓盐酸的物质的量浓度为___mol·L-1。
(2)某学生欲用上述浓盐酸和蒸馏水配制500ml物质的量浓度为0.4mol·L-1的稀盐酸,该学生需用量筒量取___ml上述浓盐酸进行配制。
(3)实验室用盐酸的浓溶液与高锰酸钾发生反应的化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O,该反应中的氧化剂是___,还原剂是___。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的原因的是
A. 铜久置空气中表面出现绿色固体:2Cu+O2+CO2+H2O═Cu2(OH)2CO3
B. 某种火箭发射阶段有少量N2O4,逸出,产生红色气体:N2O4![]() 2NO2
2NO2
C. FeSO4·7H2O在空气中久置变黄:2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O
Fe2O3+SO2↑+SO3↑+14H2O
D. SO2通入KMnO4溶液中,溶液紫色逐渐褪去:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4十2H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液240 mL;
(1)本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、_________、_________。
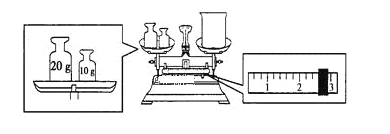
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如下图所示。烧杯的实际质量为______g,要完成本实验该同学应称出______g NaOH。
(3)使用容量瓶前必须进行的一步操作是_______________。
(4)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是_____。
A.转移溶液时不慎有少量洒到容量瓶外面
B.定容时俯视刻度线
C.未冷却到室温就将溶液转移到容量瓶并定容
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组用莫尔盐[化学式为(NH4)xFe(SO4)2·6H2O(Fe为+2价)]测定KMnO4溶液的物质的量浓度的过程如下:
①称取19.6g莫尔盐配成100mL溶液。
②量取10.00mLKMnO4溶液,向其中加入足量的H2SO4进行酸化,向酸化后的溶液中逐滴滴加莫尔盐溶液,反应完全时消耗莫尔盐溶液的体积20.00mL,所发生反应的离子方程式如下:4H++5Fe2++MnO4-=5Fe3++Mn2++4H2O请回答下列问题:
(1)(NH4)xFe(SO4)2·6H2O中x=___,c(Fe2+)=___。
(2)第①步实验中所需的玻璃仪器除量筒、烧杯、胶头滴管外还有___;
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移、定容操作。下列图对应的操作规范的是___。
a.称量 b.溶解
b.溶解 c.转移
c.转移 d.定容
d.定容![]()
(3)计算KMnO4溶液的物质的量浓度,写出计算过程。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
Ⅰ.(1)下列措施中可以使0.10mol·L-1 CH3COOH溶液的电离程度增大的是__________(填序号)。
a.加入少量0.10mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)__________V(醋酸)(填">" "<"或“=”)。
(3)某温度下,Kw=1×10-12,将 0.02mol·L-1 的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH =__________。
Ⅱ.实验表明,液态时纯硫酸的电离能力强于纯硝酸,纯硫酸的导电性也显著强于纯水。又知液态纯酸都像水那样进行自身电离(H2O+H2O![]() H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:
H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:
(1)纯硫酸在液态时自身电离的方程式是__________
(2)25℃时,液态纯硫酸的离子积常数K(H2SO4)__________(填“>”“<”或“=”)1×10-14
(3)在纯硫酸与纯硝酸的液态混合酸中,存在的阴离子主要是__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应正向反应过程中能量变化如图,下列说法正确的是
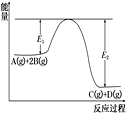
A. 该反应为吸热反应
B. 加入催化剂,反应速率增大,E1减小,E2减小,反应热不变
C. 增大压强,平衡正向移动,K增大
D. 当反应υ正(B)∶υ正(D)=2∶1时,到达平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com