
| A、乙烯分子中有一个sp2-sp2σ键和一个p-p π键 |
| B、乙炔每个碳原子都有两个未杂化的2p轨道,它们之间可形成两个π键 |
| C、乙烷两个C原子均是sp3杂化,分子中一共有6个σ键 |
| D、苯分子每个碳原子均是sp2杂化 |
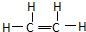 ,分子中含有一个双键和4个单键,单键中含有1个σ键,双键中含有1个σ键和1个π键;
,分子中含有一个双键和4个单键,单键中含有1个σ键,双键中含有1个σ键和1个π键;

科目:高中化学 来源: 题型:
| A、一定无Na2CO3,可能有FeCl3 |
| B、可能有Na2CO3和NaCl |
| C、一定有MgCl2,可能有NaCl |
| D、一定有NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 利用如图所示装置进行相关试验,验证铝的化合物的相关性质.请回答:
利用如图所示装置进行相关试验,验证铝的化合物的相关性质.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3;0.1 |
| B、5;0.2 |
| C、3<x<5;0.1 |
| D、3<x<5;0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热 溶解 过滤 结晶 |
| B、溶解 过滤 蒸发 结晶 |
| C、加热 溶解 蒸发 过滤 |
| D、溶解 过滤 蒸馏 蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:
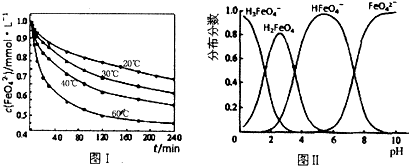
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)设计的原电池如图1所示,回答下列问题:
(1)设计的原电池如图1所示,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com