
【题目】Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题: 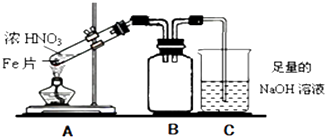
(1)甲同学完成了Fe、Cu分别与S、Cl2反应的实验,下列物质中不可能为甲同学实验得到的生成物是
A.FeCl3
B.FeCl2
C.CuCl2
D.FeS
(2)乙同学为验证Fe能和热的浓HNO3反应,设计了如图所示的实验装置,请说出装置B的作用: . 开始加热前(填“有”或“无”)明显现象.
(3)当乙同学实验结束时,铁完全溶解,试管液面上方为无色气体,试管上部为红棕色气体,此时丙同学用所得的溶液进行如下实验和探究:
①在所得的溶液中加入一小块Cu片,结果Cu片先逐渐溶解,并伴随其他现象,反应一段时间后不再溶解.丙同学依据反应现象得出Cu片溶解的原因可能是和过量的HNO3发生反应.他依据的反应现象是;该反应的离子方程式为 . 你认为Cu片溶解是否还有另一原因,若有请用化学方程式表示其理由:(若无此空不填)
②请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+ . 说明具体的操作和实验现象 .
③丙同学实验结束后加水稀释后得到溶液500mL,假设实验全过程硝酸只被还原成NO和NO2共0.02mol并测得溶液中Fe2+和Cu2+浓度均为0.02mol/L,则NO3﹣的物质的量浓度为mol/L.生成NO气体的体积为L(标准状况).
(4)本次探究实验用掉密度为1.5gcm﹣3质量分数为95%的浓硝酸3mL,超出实际参加反应的量其原因有(写出两点):①② .
【答案】
(1)B
(2)缓冲作用、防倒吸作用;无
(3)生成无色气体;试管上部出现红棕色气体;3Cu+2NO3﹣+8H+=3Cu2++2NO↑+4H2O;2Fe(NO3)3+Cu=Cu(NO3)2+2Fe(NO3)2;取该溶液少许,滴加适量的KSCN溶液,不出现红色,再滴加适量新制氯水,出现红色;0.08;0.224
(4)浓硝酸易挥发部分硝酸挥发;硝酸受热分解
【解析】解:(1.)Cl2氧化性较强,与变价金属生成高价的金属氯化物,Fe与Cl2的反应生成FeCl3 , Cu与Cl2反应生成CuCl2 , S氧化性较弱,与变价金属生成低价的金属硫化物,Fe与S的反应生成FeS,
所以答案是:B;
(2.)Fe能和热的浓HNO3反应:Fe+6HNO3(浓) ![]() Fe(NO3)3+3NO2↑+3H2O,生成的二氧化氮能和水反应3NO2+H2O=2HNO3+NO,若A与C直接连接,C中液体能倒吸到A中,所以装置B具有缓冲作用、防倒吸作用,开始加热前无反应发生所以无明显现象,
Fe(NO3)3+3NO2↑+3H2O,生成的二氧化氮能和水反应3NO2+H2O=2HNO3+NO,若A与C直接连接,C中液体能倒吸到A中,所以装置B具有缓冲作用、防倒吸作用,开始加热前无反应发生所以无明显现象,
所以答案是:缓冲作用;防倒吸作用;无;
(3.)①二氧化氮能和水反应生成硝酸和一氧化氮,当溶液中硝酸过量时,抑制二氧化氮的溶解,所以Cu片溶解的原因可能是和过量的HNO3发生反应,可看到生成无色气体,试管上部出现红棕色气体,该反应的离子方程式为3Cu+2NO3﹣+8H+=3Cu2++2NO↑+4H2O,硝酸过量时,铁和硝酸反应生成三价铁,三价铁和铜能反应生成二价铁离子和铜离子,从而使铜片溶解,发生反应为2Fe(NO3)3+Cu=Cu(NO3)2+2Fe(NO3)2 , 所以答案是:生成无色气体;试管上部出现红棕色气体;3Cu+2NO3﹣+8H+=3Cu2++2NO↑+4H2O;2Fe(NO3)3+Cu=Cu(NO3)2+2Fe(NO3)2;
②取适量反应后的溶液放入试管中,加入KSCN溶液无明显现象,再加入少量氯水,溶液变红则证明溶液中含有Fe2+但不含Fe3+ , 所以答案是:取该溶液少许,滴加适量的KSCN溶液,不出现红色,再滴加适量新制氯水,出现红色;
③丙同学实验结束后加水稀释后得到溶液500mL,溶液中Fe2+和Cu2+浓度均为0.02mol/L,溶液中NO3﹣的物质的量n(NO3﹣)=2n(Fe2+)+2n(Cu2+)=2×0.02mol/L×0.5L+2×0.02mol/L×0.5L=0.04mol,则NO3﹣的物质的量浓度为C= ![]() =
= ![]() =0.08mol/L,生成亚铁离子和铜离子失去的电子等于+5价的氮得到的电子,根据得失电子守恒3×n(NO)+1×n(NO2)=2n(Fe2+)+2n(Cu2+)=0.04mol,根据N原子守恒可知,被还原的n(HNO3)=n(NO)+n(NO2)=0.02mol,解得:n(NO)=n(NO2)=0.01mol,生成NO气体的体积为V=nVm=0.224L,
=0.08mol/L,生成亚铁离子和铜离子失去的电子等于+5价的氮得到的电子,根据得失电子守恒3×n(NO)+1×n(NO2)=2n(Fe2+)+2n(Cu2+)=0.04mol,根据N原子守恒可知,被还原的n(HNO3)=n(NO)+n(NO2)=0.02mol,解得:n(NO)=n(NO2)=0.01mol,生成NO气体的体积为V=nVm=0.224L,
所以答案是:0.08; 0.224;
(4.)本次探究实验用掉浓硝酸超出实际参加反应的量,是因为:①浓硝酸易挥发部分硝酸挥发,②硝酸受热分解,
所以答案是:①浓硝酸易挥发部分硝酸挥发; ②硝酸受热分解.


科目:高中化学 来源: 题型:
【题目】能证明SiO2是酸性氧化物的是 ( )
A.SiO2 + 3C = SiC + 2CO↑
B.SiO2 + 2NaOH = Na2SiO3 + H2O
C.SiO2 + 4HF = SiF4↑+ 2H2O
D.SiO2 + CaCO3 = CaSiO3 + CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是信息科学和能源科学中的一种重要材料,可用于制芯片和太阳能电池等.以下是工业上制取纯硅的一种方法. 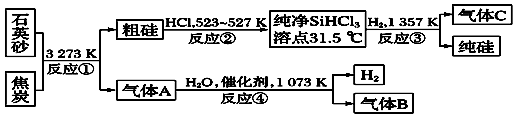
请回答下列问题(各元素用相应的元素符号表示):
(1)在上述生产过程中,属于置换反应的有(填反应代号).
(2)写出反应③的化学方程式 .
(3)化合物W的用途很广,通常可用作建筑工业和造纸工业的黏合剂,可作肥皂的填充剂,是天然水的软化剂.将石英砂和纯碱按一定比例混合加热至1 373~1 623K反应,生成化合物W,其化学方程式是
(4)A、B、C三种气体在“节能减排”中作为减排目标的一种气体是(填化学式);分别通入W溶液中能得到白色沉淀的气体是(填化学式).
(5)工业上合成氨的原料H2的制法是先把焦炭与水蒸气反应生成水煤气,再提纯水煤气得到纯净的H2 , 提纯水煤气得到纯净的H2的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是一种应用广泛的金属。下列有关铁的说法错误的是
A.铁与盐酸反应生成氯化铁与氢气B.常温下,铁在浓硫酸中会发生钝化
C.铁在氧气中燃烧生成四氧化三铁D.铁是一种银白色金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X为化学常见物质,它们的转化关系如图所示(反应条件未注明).请根据题中信息回答问题. 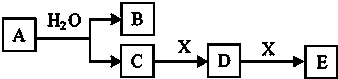
(1)若A为单质,E为白色难溶物且既能溶于盐酸又能溶于C溶液,则
①D与X发生反应的离子方程式为;
②常温下pH=10的C溶液与D溶液中,水的电离程度大(填C或D).
(2)若A为离子化合物,B为不溶于碱的白色难溶物,E与水反应生成的浓溶液G遇C有白烟产生,则
①A的化学式为;
②等物质的量浓度的G溶液与C溶液等体积混合,混合液中的质子守恒式为: . (用微粒浓度表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液既能溶解Al(OH)3,又能溶解Al,但不能溶解Fe,该溶液中可以大量共存的离子组是( )
A. K+、Na+、HCO3-、NO3-B. Na+、SO42-、Cl-、S2-
C. NH4+、Mg2+、SO42-、NO3-D. K+、Ca2+、Cl-、Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com