
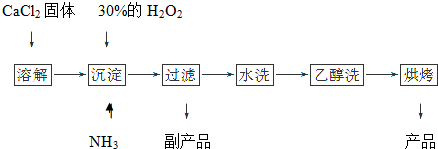
分析 (1)根据图示流程中找出反应物、生成物,写出反应的化学方程式,由工艺流程可知,反应②为氯化钙与氨水、过氧化氢反应生成CaO2•8H2O,还应生成氯化铵;
(2)通过检验洗涤液中是否含有氯离子来判断检验“水洗”是否合格,用稀硝酸酸化的硝酸银溶液检验;
(3)从双氧水的稳定性、该反应的反应热、温度对过氧化钙的溶解度的影响等方面分析;
解答 解:(1)由流程可知,反应物为氯化钙、双氧水、氨气和水,生成为CaO2•8H2O和氯化铵,反应的化学方程式为:CaCl2+H2O2+2NH3+8H2O=CaO2•8H2O↓+2NH4Cl,
故答案为:CaCl2+H2O2+2NH3+8H2O=CaO2•8H2O↓+2NH4Cl;
(2)“水洗”若不合格,洗涤液中会含有氯离子,所以检验“水洗”是否合格的方法是:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀,
故答案为:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀;
(3)由于温度较高时双氧水容易分解,会导致过氧化钙产率下降,且温度降低时过氧化钙的溶解度减小,有利于过氧化钙的析出,该反应是放热反应,温度低有利于提高CaO2•8H2O产率,所以沉淀反应时常用冰水浴控制温度在0℃左右,
故答案为:温度低可减少过氧化氢的分解,提高过氧化氢的利用率;该反应是放热反应,温度低有利于提高CaO2•8H2O产率.
点评 本题考查形式为物质制备流程图题目,涉及化学反应方程式的书写、物质的检验等问题,题目难度较大,做题时注意分析题中关键信息、明确实验基本操作方法,本题较为综合,充分考查了学生的分析、化学实验能力.


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将a molL-1 HCN溶液与a molL-1 NaOH溶液等体积混合,混合液中:c(OH-)>c(H+),c(Na+)>c(CN-) | |
| B. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 | |
| D. | NaHCO3和Na2CO3混合液中,一定有c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L的苯所含的分子个数为0.5NA | |
| B. | 28 g乙烯所含共用电子对数目为4NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含原子个数为2.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子个数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直链烷烃中,碳原子数越多沸点越高 | |
| B. | 碳原子数相同的烷烃,支链越多沸点越高 | |
| C. | 相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃 | |
| D. | 碳原子数相同的醇,羟基越多沸点越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点/℃ | 沸点/℃ | 密度/g•mL-1 | 其他 | |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3;2P+5Cl2(过量)$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com