
| A. | 光导纤维、氧化铝陶瓷、硅藻土都是无机非金属材料 | |
| B. | 节能减排防治PM2.5,PM2.5是指大气中直径小于或等于2.5纳米的可吸入颗粒物 | |
| C. | 汽车尾气中的氮氧化物和碳氢化合物在大气环境中受强烈的太阳紫外线照射后产生一种新的二次污染物-光化学烟雾也会引起雾霾,汽车尾气中含有氮氧化物的原因是汽油燃烧不充分 | |
| D. | 超级病菌NDM-l几乎对所有抗生素都具有抗药性,死亡率很高.为防止超级病菌的感染,要加强环境、个人的卫生和消毒,其中消毒剂常选用含氯消毒剂、双氧水、酒精等氧化性强的物质 |
分析 A.无机非金属材是以某些元素的氧化物、碳化物、氮化物、卤素化合物、硼化物以及硅酸盐、铝酸盐、磷酸盐、硼酸盐等物质组成的材料,根据无机非金属材料概念判断;
B.PM2.5是指大气中直径小于或等于2.5微米的颗粒物;
C.汽油的成分为烃,燃烧不会生成氮的氧化物;
D.含氯消毒剂、双氧水、酒精等是消毒剂.
解答 解:A.光导纤维、氧化铝陶瓷、硅藻土都是无机非金属材料,故A正确;
B.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,故B错误;
C.汽油的成分为烃,无论燃烧是否充分,燃烧产物中不可能有氮的氧化物,故C错误;
D.细菌的成分是蛋白质,含氯消毒剂、双氧水具有强氧化性能使蛋白质变性,乙醇不具有强氧化性,但是能够使蛋白质变性,具有杀菌消毒作用,故D错误;
故选:A.
点评 本题考查了生活中常见材料的分类、环境污染与治理、蛋白质的性质,掌握基础是解题关键,注意pM2.5的概念,题目难度不大.


科目:高中化学 来源: 题型:解答题
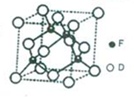 A、B、D、E、F是原子序数依次增大的五种前四周期元素,相关信息如下:
A、B、D、E、F是原子序数依次增大的五种前四周期元素,相关信息如下:| A | 原子半径最小的元素 |
| B | 原子核外电子有6种不同的运动状态 |
| E | 原子L电子层上有两个未成对电子 |
| F | 原子最外层有2个电子,次外层电子数为D原子最外层电子数的2倍 |
 ,能量最高的电子占据的能级符号为3d,该能级所在能层具有的原子轨道数为9.
,能量最高的电子占据的能级符号为3d,该能级所在能层具有的原子轨道数为9.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 名称或俗名 | 主要用途 |
| K2FeO4 | 高铁酸钾 | 高能材料、水处理剂和氧化剂 |
| H2C2O4 | 草酸 | 重要还原剂、菠菜成分之一 |
| KAl(SO4)2•12H2O | 明矾 | 净水剂、用于制油条和糕点 |
| Cu2O | 氧化亚铜 | 用于制红色涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鉴别葡萄糖溶液和淀粉溶液:加入新制的Cu(OH)2悬浊液加热或加碘水 | |
| B. | 鉴别织物成分是真丝还是人造丝:用灼烧的方法 | |
| C. | 鉴别淀粉溶液和蛋白质溶液:加入稀KI溶液 | |
| D. | 鉴别乙烷和乙烯:分别将气体通入溴水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组合分类 | 碱 | 酸 | 纯净物 | 碱性氧化物 | 酸性氧化物 |
| A | 烧碱 | H2SO4 | 盐酸 | CaO | SO3 |
| B | 纯碱 | HCl | 冰醋酸 | Na2O2 | CO2 |
| C | NaOH | CH3COOH | 冰水混合物 | Na2O | SO2 |
| D | KOH | HNO3 | 胆矾 | Al2O3 | CO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
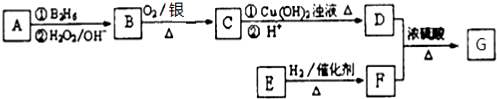
 :
: ;
; ;
;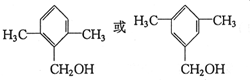 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
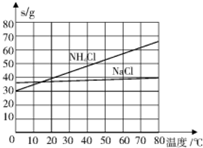 碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的某本原料.
碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的某本原料.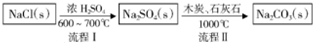
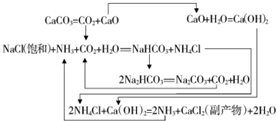
| 物质 | NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3 |
| s/g | 35.9 | 37.2 | 9.6 | 21.7 | 21.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 3.8 | - |
| Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
| Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
| Ni(OH)2 | 6.5×10-18 | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | 最简单氢化物的沸点:Y>W | |
| C. | 化合物Z2Y2与X2Y2中化学键完全相同 | |
| D. | 由Y、Z、W三种元素组成的化合物的水溶液一定显中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com