
����Ŀ���ߴ�̼�����ڵ��ӹ�ҵ������Ҫ��Ӧ�ã�ʪ���������̿���Ҫ�ɷ�ΪMnO2 �� ������Fe��Al��Mg������Ԫ�أ��Ʊ��ߴ�̼���̵�ʵ��������£� 
��1������������ʱ�¶ȿ�����90�桫95��֮�䣬����Ҫ��������3Сʱ��Ŀ���� �� ֲ��۵������� ��
��2�����ӣ��������Һ�м���һ������̼���̿��ڽ���Һ��pHΪ3.5��5.5�� ���ټ���һ���������̿��˫��ˮ�����ˣ�
�ۡ�
��������ʹ��̼���̵�pH�����������������м���˫��ˮ�����ܽ�Fe2+����ΪFe3+ �� ������������̿�Ľ����ʣ�д��˫��ˮ������̿�����ʵ����ӷ���ʽ ��
��3���Ʊ�����30�桫35���£���̼�������Һ�μӵ������̾���Һ�У����Ʒ�ӦҺ������pH��6.5��7.0���õ�MnCO3�������¶ȿ���35�����µ�ԭ�������÷�Ӧ�Ļ�ѧ����ʽΪ�����ɵ�MnCO3�����辭���ϴ�ӣ�����ϴ���Ƿ���ȫ�ķ����� ��
��4�����㣺�����£�Ksp��MnCO3��=1.8��10��11 �� Ksp��MgCO3��=2.6��10��5 �� ��֪����Ũ��С��1.0��10��5molL��1ʱ����ʾ�����ӳ�����ȫ��������Һ�е�c��Mg2+��=10��2mol/L���Լ���˵��Mg2+�Ĵ����Ƿ��Ӱ��MnCO3�Ĵ��ȣ�
���𰸡�
��1��������̿����̵Ľ����ʣ�����ԭ��
��2������MnCO3�IJ������������µ����ʵȣ���MnO2+H2O2+2H+=Mn2++2H2O+O2��
��3������̼����淋ķֽ⣬���ԭ�������ʣ�MnSO4+2NH4HCO3 ![]() MnCO3+��NH4��2SO4+CO2��+H2O��ȡ���һ�ε�ϴ����Һ1��2mL���Թ��У������еμ��������ữ��BaCl2��Һ�����ް�ɫ�����������������ϴ�Ӹɾ�
MnCO3+��NH4��2SO4+CO2��+H2O��ȡ���һ�ε�ϴ����Һ1��2mL���Թ��У������еμ��������ữ��BaCl2��Һ�����ް�ɫ�����������������ϴ�Ӹɾ�
��4���⣺Ksp ��MnCO3��=c��Mn2+��c��CO32��������Mn2+������ȫʱ��c��CO32����= ![]() ��10��5=1.8��10��6 molL��1����Mg2+Ҳ���γɳ�������Ҫ��Mg2+��2.6��10��5/1.8��10��6=14.4 molL��1��Mg2+��Ũ��0.01mol/LԶС��14.4 molL��1��������Һ�е�c��Mg2+��=10��2mol/L��˵��Mg2+�Ĵ��ڲ���Ӱ��MnCO3�Ĵ��ȣ�
��10��5=1.8��10��6 molL��1����Mg2+Ҳ���γɳ�������Ҫ��Mg2+��2.6��10��5/1.8��10��6=14.4 molL��1��Mg2+��Ũ��0.01mol/LԶС��14.4 molL��1��������Һ�е�c��Mg2+��=10��2mol/L��˵��Mg2+�Ĵ��ڲ���Ӱ��MnCO3�Ĵ��ȣ�
��Ksp ��MnCO3��=c��Mn2+��c��CO32��������Mn2+������ȫʱ��c��CO32����= ![]() ��10��5=1.8��10��6 molL��1����Mg2+Ҳ���γɳ�������Ҫ��Mg2+��2.6��10��5/1.8��10��6=14.4 molL��1��Mg2+��Ũ��0.01mol/LԶС��14.4 molL��1��������Һ�е�c��Mg2+��=10��2mol/L��˵��Mg2+�Ĵ��ڲ���Ӱ��MnCO3�Ĵ��ȣ�
��10��5=1.8��10��6 molL��1����Mg2+Ҳ���γɳ�������Ҫ��Mg2+��2.6��10��5/1.8��10��6=14.4 molL��1��Mg2+��Ũ��0.01mol/LԶС��14.4 molL��1��������Һ�е�c��Mg2+��=10��2mol/L��˵��Mg2+�Ĵ��ڲ���Ӱ��MnCO3�Ĵ��ȣ�
���������⣺��1�����¡����趼���Լӿ����ʵ��ܽⷴӦ���ʣ�����ʱ�¶ȿ�����90�桫95��֮�䣬����Ҫ��������3Сʱ��Ŀ����������̿����̵Ľ����ʣ�����ֲ�����һ�ֻ�ԭ�����ʴ�Ϊ��������̿����̵Ľ����ʣ�����ԭ������2��ʹ��̼���̵�pH�������Dz������µ����ʣ�������Һ�ж�������������������Ϊ��������������ԭΪ�����ӣ���Ӧ�����ӷ���ʽΪ��MnO2+H2O2+2H+=Mn2++2H2O+O2�����ʴ�Ϊ������MnCO3�IJ������������µ����ʵȣ��� MnO2+H2O2+2H+=Mn2++2H2O+O2������3������̼����������ֽ�������¶ȿ���35�����µ�ԭ���Ƿ�ֹ̼����立ֽ⣬��30�桫35���£���̼�������Һ�μӵ������̾���Һ�У����Ʒ�ӦҺ������pH��6.5��7.0���õ�MnCO3����������泥�������̼��ˮ����Ӧ�Ļ�ѧ����ʽΪ��MnSO4+2NH4HCO3 ![]() MnCO3+��NH4��2SO4+CO2��+H2O�����ɵ�MnCO3�����辭���ϴ�ӣ�����ϴ���Ƿ���ȫ�ķ�����ȡ���һ��ϴ��Һ�����Ƿ��������������ƣ�ȡ���һ�ε�ϴ����Һ1��2 mL ���Թ��У������еμ��������ữ��BaCl2��Һ�����ް�ɫ�����������������ϴ�Ӹɾ����ʴ�Ϊ������̼����淋ķֽ⣬���ԭ�������ʣ�MnSO4+2NH4HCO3
MnCO3+��NH4��2SO4+CO2��+H2O�����ɵ�MnCO3�����辭���ϴ�ӣ�����ϴ���Ƿ���ȫ�ķ�����ȡ���һ��ϴ��Һ�����Ƿ��������������ƣ�ȡ���һ�ε�ϴ����Һ1��2 mL ���Թ��У������еμ��������ữ��BaCl2��Һ�����ް�ɫ�����������������ϴ�Ӹɾ����ʴ�Ϊ������̼����淋ķֽ⣬���ԭ�������ʣ�MnSO4+2NH4HCO3 ![]() MnCO3+��NH4��2SO4+CO2��+H2O��ȡ���һ�ε�ϴ����Һ1��2 mL ���Թ��У������еμ��������ữ��BaCl2��Һ�����ް�ɫ�����������������ϴ�Ӹɾ��� ʪ���������̿���Ҫ�ɷ�ΪMnO2 �� ������Fe��Al��Mg������Ԫ�أ��Ʊ��ߴ�̼���̣�����Ũ�����ֲ��۽������˵õ���Һ��ȥ���ʣ�����̼������γɳ���ͨ��һϵ�в����õ��ߴ�̼���̣���1�����½��趼���Լӿ����ʵ��ܽⷴӦ���ʣ�����ֲ�����һ�ֻ�ԭ������2��ʹ��̼���̵�pH�������Dz������µ����ʣ���������������������Ϊ��������������ԭΪ�����ӣ���3������̼����������ֽ��������30�桫35���£���̼�������Һ�μӵ������̾���Һ�У����Ʒ�ӦҺ������pH��6.5��7.0���õ�MnCO3����������泥�������̼��ˮ�����ɵ�MnCO3�����辭���ϴ�ӣ�����ϴ���Ƿ���ȫ�ķ�����ȡ���һ��ϴ��Һ�����Ƿ��������������ƣ���4��Ksp ��MnCO3��=c��Mn2+��c��CO32��������Mn2+������ȫʱ��c��CO32����=1.8��10��11/1.0��10��5=1.8��10��6 molL��1 �� ��Mg2+Ҳ���γɳ�������Ҫ��Mg2+��2.6��10��5/1.8��10��6=14.4 molL��1 �� Mg2+��Ũ��0.01mol/LԶС��14.4 molL��1 ��
MnCO3+��NH4��2SO4+CO2��+H2O��ȡ���һ�ε�ϴ����Һ1��2 mL ���Թ��У������еμ��������ữ��BaCl2��Һ�����ް�ɫ�����������������ϴ�Ӹɾ��� ʪ���������̿���Ҫ�ɷ�ΪMnO2 �� ������Fe��Al��Mg������Ԫ�أ��Ʊ��ߴ�̼���̣�����Ũ�����ֲ��۽������˵õ���Һ��ȥ���ʣ�����̼������γɳ���ͨ��һϵ�в����õ��ߴ�̼���̣���1�����½��趼���Լӿ����ʵ��ܽⷴӦ���ʣ�����ֲ�����һ�ֻ�ԭ������2��ʹ��̼���̵�pH�������Dz������µ����ʣ���������������������Ϊ��������������ԭΪ�����ӣ���3������̼����������ֽ��������30�桫35���£���̼�������Һ�μӵ������̾���Һ�У����Ʒ�ӦҺ������pH��6.5��7.0���õ�MnCO3����������泥�������̼��ˮ�����ɵ�MnCO3�����辭���ϴ�ӣ�����ϴ���Ƿ���ȫ�ķ�����ȡ���һ��ϴ��Һ�����Ƿ��������������ƣ���4��Ksp ��MnCO3��=c��Mn2+��c��CO32��������Mn2+������ȫʱ��c��CO32����=1.8��10��11/1.0��10��5=1.8��10��6 molL��1 �� ��Mg2+Ҳ���γɳ�������Ҫ��Mg2+��2.6��10��5/1.8��10��6=14.4 molL��1 �� Mg2+��Ũ��0.01mol/LԶС��14.4 molL��1 ��


 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д� �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ÿ��Խ���������CO2ת��Ϊȼ������CO������˵���У�����ȷ����
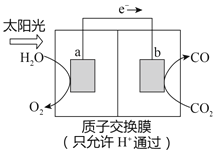
A. �缫b���淢����ԭ��Ӧ
B. ��װ�ù���ʱ��H+��a������b�����ƶ�
C. ��װ����ÿ����1molCO��ͬʱ����0.5molO2
D. �ù����ǽ���ѧ��ת��Ϊ���ܵĹ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣�������ĸ�ֱ��ʾһ��Ԫ�ء���ش���������:
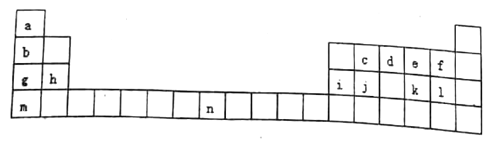
��1��a��һ�ֺ��غ�����һ�����ӡ�һ���������ú��صķ���Ϊ______��
��2�� д��Ԫ��j�����ڱ��е�λ��____________����֪nԭ�ӵ���������������ӣ�������ԭ�ӵĽṹʾ��ͼ____________��
��3��a��d��f��g��m ����Ԫ�ص�ԭ�Ӱ뾶��С�����˳��Ϊ________(��Ԫ�ط��ű�ʾ)��
��4�� c��d��j��l����Ԫ������������Ӧ��ˮ�����������ǿ������˳��Ϊ______(�û�ѧʽ��ʾ)��
��5������Ԫ���γɵ��⻯�������ȶ�����_____(��д���ƣ���ͬ)������ˮ�Լ��Ե���_____��
��6��e��k ����Ԫ�صõ�������ǿ����_____ (��Ԫ�ط��ű�ʾ)���û�ѧ����ʽ֤������_____ ��
��7��Ԫ��a��e �γɵ�ԭ�Ӹ���1:1�Ļ�����ķ���ʽΪ_____��������ѧ��������Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4mol A�����2mol B������2L���ܱ������ڻ�ϣ�����һ�������·������·�Ӧ��2A��g��+B��g��2C��g��������2s����C��Ũ��Ϊ0.6molL��1 �� �������м���˵���� ��������A��ʾ�ķ�Ӧ��ƽ������Ϊ0.3molL��1s��1
��������B��ʾ�ķ�Ӧ��ƽ������Ϊ0.6molL��1s��1
��2sʱ����A��ת����Ϊ70%
��2sʱ����B��Ũ��Ϊ0.7molL��1
������ȷ���ǣ� ��
A.�٢�
B.�٢�
C.�ڢ�
D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ӣ�F������õķ�������������ʹҩ���������Ƹ�ð���ա��ؽ�ʹ����ʹ��ƫͷʹ�ȣ����������ϩ��A�Ⱥϳɣ�
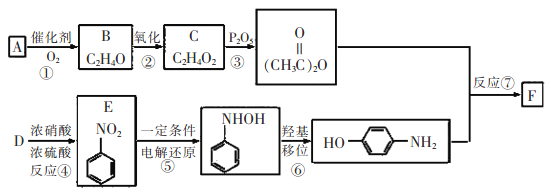
��֪��![]()
��ش��������⣺
��1��E������Ϊ__________��C�к��еĹ�������__________��
��2��B�Ľṹ��ʽ��__________����Ӧ�۵ķ�Ӧ������__________��
��3��F������NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ__________��
��4��F��ͬ���칹���кܶ࣬����һ��ͬʱ��������������ͬ���칹�干��_______�֡�
�ٱ���������������������FeCl3��Һ������ɫ��Ӧ�����ܷ���������Ӧ��ȩ��ֱ�����ڱ����ϡ�
��5������F�ĺϳ�·�ߣ����һ�����屽Ϊ��ʼԭ���Ʊ�![]() �ĺϳ�·��___________��
�ĺϳ�·��___________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com