
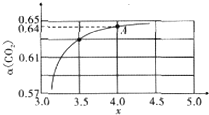
 已知:2CrO42-+2H+?Cr2O72-+H2O.25℃时,调节初始浓度为1.0mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线.下列说法不正确的是( )
已知:2CrO42-+2H+?Cr2O72-+H2O.25℃时,调节初始浓度为1.0mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线.下列说法不正确的是( )| A. | 平衡时,pH越小,c(Cr2O72-)越大 | |
| B. | A点CrO42-的平衡转化率为50% | |
| C. | A点CrO42-转化为Cr2O72-反应的平衡常数K=1014 | |
| D. | 平衡时,若溶液中c(Cr2O72-)=c(Cr2O42-),则c(H+)>2.0×10-7 mol•L-1 |
分析 A、由图可知氢离子浓度越大,c(Cr2O72-)越大;
B、由图可知A点时CrO42-的平衡浓度为0.25mol/L;
C、2CrO42-+2H+?Cr2O72-+H2O的平衡常数为:K=$\frac{c(C{r}_{2}{{O}_{7}}^{2-})}{{c}^{2}(Cr{O}_{4}^{2-})•c({H}^{+})}$;
D、平衡时,若溶液中c(Cr2O72-)=c(CrO42-),而2c(Cr2O72-)+c(CrO42-)=1.0mol•L-1,所以c(Cr2O72-)=$\frac{1}{3}$mol•L-1,结合图象分析解答.
解答 解:A、由图可知氢离子浓度越大,c(Cr2O72-)越大,所以pH越小,c(Cr2O72-)越大,故A正确;
B、由图可知A点时Cr2O72-的平衡浓度为0.25mol/L,所以转化的CrO42-的浓度为:0.5mol/L,则A点CrO42-的平衡转化率为50%,故B正确;
C、2CrO42-+2H+?Cr2O72-+H2O的平衡常数为:K=$\frac{c(C{r}_{2}{{O}_{7}}^{2-})}{{c}^{2}(Cr{O}_{4}^{2-})•c({H}^{+})}$=$\frac{0.25}{(0.{5×1{0}^{-7})}^{2}×1}$=1014,故C正确;
D、平衡时,若溶液中c(Cr2O72-)=c(CrO42-),而2c(Cr2O72-)+c(CrO42-)=1.0mol•L-1,所以c(Cr2O72-)=$\frac{1}{3}$mol•L-1,而图中c(Cr2O72-)=0.35mol/L时,对应氢离子的浓度为2.0×10-7 mol•L-1,则溶液中c(Cr2O72-)=c(Cr2O42-),则c(H+)<2.0×10-7 mol•L-1,故D错误;
故选D.
点评 本题考查图象的分析、溶度积常数的计算的知识,注意平衡常数的理解应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 黑色沉淀完全转化为白色沉淀 | B. | 既有 Ag2S 也有 AgCl | ||
| C. | 不能由黑色沉淀转变为白色沉淀 | D. | 只有 AgCl 白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
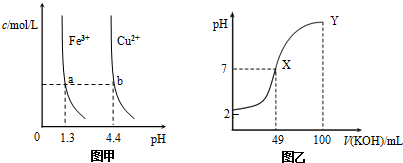
| A. | 由图甲知:Ksp[Fe(OH)3]<Ksp[Cu(OH)2] | |
| B. | 由图甲知:a、b点溶液中Kw,b点的大 | |
| C. | 由图乙知:HA为强酸 | |
| D. | 由图乙知:Y点对应的溶液中c(K+)>c(A-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 尿素作为一种中性肥料,适用于各种土壤和植物.它易保存,使用方便,对土壤的破坏作用小,是目前使用量较大的一种化学氮肥.
尿素作为一种中性肥料,适用于各种土壤和植物.它易保存,使用方便,对土壤的破坏作用小,是目前使用量较大的一种化学氮肥.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 静置后的淘米水能产生丁达尔现象,这种“淘米水”是胶体 | |
| B. | “洁厕灵”有效成分为盐酸,与漂白粉混合使用效果更佳 | |
| C. | 新型能源生物柴油和矿物油主要化学成分相同 | |
| D. | 铝热反应中可得到铁,工业上可以利用该反应来大量生产铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com