
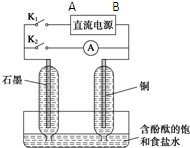
 某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.
某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.
| ||
| ||


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
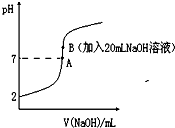 氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF?H++F-.25℃下,向20mL0.2mol?L-1的氢氟酸中滴加0.2mol?L-1的NaOH溶液时,溶液的pH变化如图所示.
氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF?H++F-.25℃下,向20mL0.2mol?L-1的氢氟酸中滴加0.2mol?L-1的NaOH溶液时,溶液的pH变化如图所示.| n(已电离的弱电解质) |
| n(全部的弱电解质) |
| c(H+)?c(F-) |
| c(HF) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有的无机化学反应不属于化合、分解、置换、复分解中的任何一种反应 |
| B、某物质在固态时能导电,可确认该物质是金属单质 |
| C、一种元素在同一物质中可显示不同价态,但一定是该元素的相邻价态 |
| D、氧化物只可能是氧化产物,不可能是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2和SO2中物质的量比为1:1 |
| B、CO2和SO2的密度比为1:1 |
| C、CO2和SO2的物质的量浓度比为11:16 |
| D、CO2和SO2中所含氧原子个数比为16:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氮气 | B、氧气 | C、水蒸气 | D、甲烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com