
| A、46 | B、61.3 |
| C、76.7 | D、69 |
科目:高中化学 来源: 题型:
| A、向AgCl悬浊液中加入足量的NaI溶液,无明显现象 |
| B、CCl4和NH3两分子各原子最外层均满足8电子结构 |
| C、若短周期R2+和M+的电子层结构相同,则金属性R>M |
| D、硝酸铵溶于水吸热,是焓减熵增的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgX | B、AgY |
| C、AgZ | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
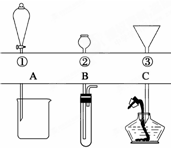 如图所示,①~③是几种漏斗的上部,A、B、C是实际操作(分液、制气、向容器中加液体试剂等)时,各种漏斗的下部插入容器中的示意图.请根据实际操作时上述漏斗的使用范围和它们的形状,指出A~C分别与①~③中哪一种最匹配(图中漏斗及容器中的药品和其他物品均已略去,铁架台、铁夹也已略去).A与
如图所示,①~③是几种漏斗的上部,A、B、C是实际操作(分液、制气、向容器中加液体试剂等)时,各种漏斗的下部插入容器中的示意图.请根据实际操作时上述漏斗的使用范围和它们的形状,指出A~C分别与①~③中哪一种最匹配(图中漏斗及容器中的药品和其他物品均已略去,铁架台、铁夹也已略去).A与查看答案和解析>>
科目:高中化学 来源: 题型:
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |
查看答案和解析>>
科目:高中化学 来源: 题型:
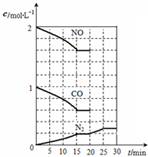 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ?mol-1低温可自发进行 |
| B、常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
| C、室温时,0.1mol/L某一元酸在水中有0.1%电离,此酸的电离平衡常数约为1×10-7 |
| D、将镁条和铝片用导线连接再插进稀NaOH溶液,镁条上产生气泡,说明铝比镁活泼 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com