
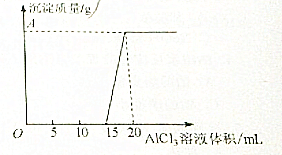
 为测定AlCl3溶液的物质的量浓度,某学生把AlCl3溶液滴入到20mL 0.3mol/L的NaOH溶液中,滴入AlCl3溶液的体积与生成沉淀的质量关系如下图.则AlCl3溶液的物质的量浓度为多少?A点值为多少?
为测定AlCl3溶液的物质的量浓度,某学生把AlCl3溶液滴入到20mL 0.3mol/L的NaOH溶液中,滴入AlCl3溶液的体积与生成沉淀的质量关系如下图.则AlCl3溶液的物质的量浓度为多少?A点值为多少?| 1 |
| 4 |
| 0.006mol |
| 4 |
| 0.0015mol |
| 0.015L |


科目:高中化学 来源: 题型:
 氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一. 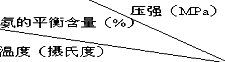 | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含有HBr,可能含有CO2、Cl2 |
| B、一定不含CO2 |
| C、一定不含NH3、Cl2 |
| D、可能含有Cl2、CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO32-、SO42-、K+、Na+ |
| B、Ag+、NO3-、Cu2+、Na+ |
| C、SO2、Ba2+、Cl-、K+ |
| D、AlO2-、Br-、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
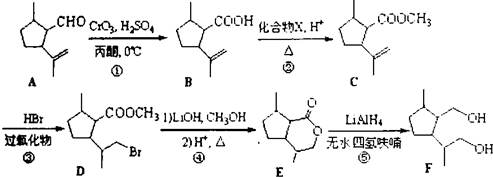
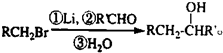 化合物
化合物  是合成抗癌药物白黎芦醇的中间体,请写出以
是合成抗癌药物白黎芦醇的中间体,请写出以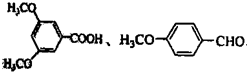 和CH3OH为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2
和CH3OH为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向稀盐酸中加入少量钠粒:2Na+2H2O=2Na++2OH-+H2↑ |
| B、向氯化铁溶液中滴加偏铝酸钠溶液:Fe3++3AlO2-+6H2O=Fe(OH)3↓+3Al(OH)3↓ |
| C、Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++HCO3-+OH-=MgCO3↓+H2O |
| D、向含氯化铝的氯化镁溶液中加入氧化镁:Al3++MgO+H2O=Al(OH)3↓+Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温下,0.1mol/L CH3COONH4溶液和0.1mol/L CH3C00Na溶液中,由水电离的c(H+),前者小于后者 |
| B、反应2A(s)+B(g)═2C(g)+D(g)不能自发进行,则该反应△H一定大于0 |
| C、同温下,已知醋酸电离平衡常熟为Ka,醋酸根水解常数为Kb,水的离子积为Kw.则三者关系为:Ka?Kb=Kw |
| D、反应A(g)?2B(g)△H,若正反应的活化能为EakJ?mol-1,逆反应的活化能为EbkJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com