

| 9(b-a) |
| a |
| 900(b-a) |
| a |
| 9(b-a) |
| a |
| 900(b-a) |
| a |
| ���� | Cu��OH��2 | Fe��OH��2 | Fe��OH��3 |
| ��ʼ����pH | 6.0 | 7.5 | 1.4 |
| ������ȫpH | 13 | 14 | 3.7 |
| 288g��(b-a)g |
| 32g |
| 9(b-a) |
| a |
| 9(b-a) |
| a |
| 900(b-a) |
| a |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��������ͭ�ĵ��ʡ��Ͻ��仯���������������е�Ӧ�������㷺��
��������ͭ�ĵ��ʡ��Ͻ��仯���������������е�Ӧ�������㷺��
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ���� | Cu��OH��2 | Fe��OH��2 | Fe��OH��3 |
| ��ʼ����pH | 6.0 | 7.5 | 1.4 |
| ������ȫpH | 13 | 14 | 3.7 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
| ���� |

| 5 |
| 11 |
| 5 |
| 11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���Ĵ�ʡ��Ԫ�и����ڶ�������Կ������ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
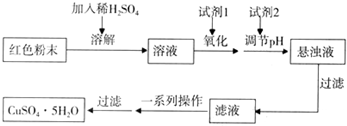
������������������ͭ�Ǻ�ɫ��ĩ���������ϡ�ijУһ��ѧʵ��С��ͨ��ʵ����̽��һ��ɫ��ĩ��Fc2O3��Cu2O����ߵĻ���̽���������£�
��������֪��Cu2O��һ�ּ������������ϡ��������Cu��CuSO4���ڿ����м�������CuO��
������裺����l����ɫ��ĩ��Fc2O3 ����2����ɫ��ĩ��Cu2O
����3����ɫ��ĩ��Fc2O3��Cu2O�Ļ����
���ʵ�飺ȡ������ĩ��������ϡ�����У���������Һ���ٵμ�KSCN��Һ��
��1��������1��������ʵ��������__ ��
��2�������� KSCN��Һ����Һ�����ɫ����֤��ԭ�����ĩ��һ����������������������Ϊ����˵��������____��Ͳ��������� .
��3���������ĩ��ȫ�ܽ�������ڣ��μ�KSCN��Һʱ��Һ�����ɫ����֤��ԭ�����ĩ��Fc2O3����Cu2O�Ļ�������������Ϊ____��д�����з�����������ԭ��Ӧ�����ӷ���ʽ ��̽�����죺��ʵ�������ȷ����ɫ��ĩΪFc2O3����Cu2O�Ļ���
��4��ʵ��С�����ü��ȷ��ⶨCu2O������������ȡag�����ĩ�ڿ����г�ּ��ȣ����������ٱ仯ʱ����������Ϊbg ����������Cu2O����������Ϊ
��
����������Cu2O����������Ϊ
��
��5��ʵ��С�������øú�ɫ��ĩ��ȡ�ϴ����ĵ�����CuSO4��5H2O�������������ϵ�֪����Һ��ͨ��������Һ������Զ�ʹCu2+��Fe3+��Fe2+�ֱ����ɳ�����pH���£�
|
�� �� |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
��ʼ����pH |
6.0 |
7.5 |
1.4 |
|
������ȫpH |
13 |
14 |
3.7 |
ʵ�����������Լ��ɹ�ѡ�� A����ˮ B��H2O2 C��NaOH D��Cu2��OH��2CO3
ʵ��С���������ʵ�鷽����
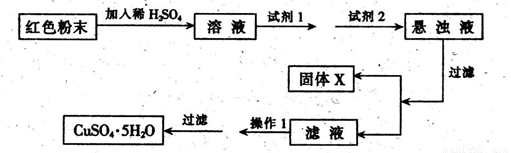
�Իش𣺢��Լ�1Ϊ___ _���Լ�2Ϊ ������ĸ����
�ڹ���X�Ļ�ѧʽΪ____���۲���IΪ_ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | Cu��OH��2 | Fe��OH��2 | Fe��OH��3 |
| ��ʼ����pH | 6.0 | 7.5 | 1.4 |
| ������ȫpH | 13 | 14 | 3.7 |

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com