
| A. | 充电过程是化学能转化为电能的过程 | |
| B. | 充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O | |
| C. | 放电时负极附近溶液的酸性增强 | |
| D. | 放电时电解质溶液中的OH-向正极移动 |
分析 A、充电过程是电解池,是电能转化为化学能;
B、充电过程是电解池,阳极失电子发生氧化反应,元素化合价升高;
C、放电时原电池,负极上失电子发生氧化反应,电极附近生成氢氧化镉沉淀;
D、放电时原电池,氢氧根离子移向负极.
解答 解:A、充电过程是电解池,是电能转化为化学能的过程,故A错误;
B、充电时阳极反应是Ni(OH)2+OH--e-=NiOOH+H2O,故B正确;
C、放电时负极上发生氧化反应,Cd-2e-+2OH-=Cd(OH)2电极附近溶液的碱性减弱,故C错误;
D、放电时,阳极负极电极反应,电解质溶液中OH-向负极移动,故D错误;
故选B.
点评 本题考查了电解池和原电池的原理应用,能量转化,主要是电极名称、电极反应、电极判断,掌握原电池和电解池的工作原理是关键


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W分子中碳、氢质量比为1:2 | B. | W同分异构体有5种 | ||
| C. | 经红外光谱测定W最多有4个甲基 | D. | 在核磁共振氢谱中W最少有2个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
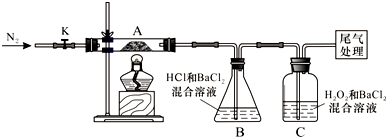
 用下面两种方法可以制得白色的Fe(OH)2沉淀.
用下面两种方法可以制得白色的Fe(OH)2沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
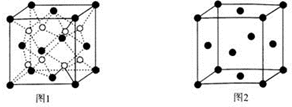
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
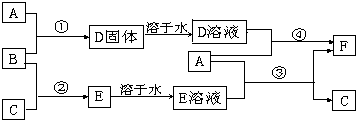
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
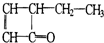 ,可表示为
,可表示为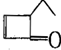 ,某有机物
,某有机物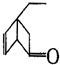 的多种同分异构体中,属于芳香醇的一共有(不考虑立体异构)( )
的多种同分异构体中,属于芳香醇的一共有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏可获得汽油、煤油等矿物油,煤焦油干馏可获得苯、甲苯等有机物 | |
| B. | 使用“乙醇汽油”、“燃煤固硫”、“汽车尾气催化净化”等可提高空气质量 | |
| C. | 金刚石呈正四面体网状结构、C60呈笼状结构,这两种晶体中微粒间的作用力不完全相同 | |
| D. | 硬脂酸甘油酯在碱性条件下的水解属于皂化反应,乙酸乙酯在碱性条件下的水解不属于皂化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com