
”¾ĢāÄæ”浄¾§¹čŹĒŠÅĻ¢²śŅµÖŠÖŲŅŖµÄ»ł“”²ÄĮĻ”£¹¤ŅµÉĻæÉÓĆ½¹ĢæÓė¶žŃõ»Æ¹čµÄ»ģŗĻĪļŌŚøßĪĀĻĀÓėĀČĘų·“Ӧɜ³ÉSiCl4ŗĶCO£¬SiCl4¾Ģį“æŗóÓĆĒāĘų»¹ŌµĆøß“æ¹č”£ŅŌĻĀŹĒŹµŃéŹŅÖʱøSiCl4µÄ×°ÖĆŹ¾ŅāĶ¼”£

ŹµŃé¹ż³ĢÖŠ£¬ŹÆӢɰ֊µÄĢś”¢ĀĮµČŌÓÖŹŅ²ÄÜ×Ŗ»ÆĪŖĻąÓ¦ĀČ»ÆĪļ£¬SiCl4”¢AlCl3”¢FeCl3ÓöĖ®¾łŅ×Ė®½ā£¬ÓŠ¹ŲĪļÖŹµÄĪļĄķ³£Źż¼ūÓŅ±ķ£ŗ
ĪļÖŹ | SiCl4 | AlCl3 | FeCl3 |
·Šµć/”ę | 57.7 | £ | 315 |
ČŪµć/”ę | -70.0 | £ | £ |
»ŖĪĀ¶Č/”ę | £ | 180 | 300 |
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©×°ÖĆBÖŠµÄŹŌ¼ĮŹĒ____________£¬×°ÖĆDµÄÓ²ÖŹ²£Į§¹ÜÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ_______________”£
£Ø2£©D”¢E¼äµ¼¹Ü¶ĢĒŅ“ÖµÄŌŅņŹĒ________________________”£
£Ø3£©GÖŠĪüŹÕĪ²ĘųŅ»¶ĪŹ±¼äŗó£¬ĪüŹÕŅŗÖŠæĻ¶Ø“ęŌŚOH-”¢Cl-ŗĶSO42-”£ĒėÉč¼ĘŹµŃ飬Ģ½¾æøĆĪüŹÕŅŗÖŠæÉÄÜ“ęŌŚµÄĘäĖūĖįøłĄė×Ó£ØŗöĀŌæÕĘųÖŠCO2µÄÓ°Ļģ£©”£
”¾Ģį³ö¼ŁÉč”æ¼ŁÉč1£ŗÖ»ÓŠSO32-£»¼ŁÉč2£ŗ¼ČĪŽSO32-Ņ²ĪŽClO-£»¼ŁÉč3£ŗ____________”£
”¾Éč¼Ę·½°ø£¬½ųŠŠŹµŃé”ææɹ©Ń”ŌńµÄŹµŃéŹŌ¼ĮÓŠ£ŗ3mol/L H2SO4”¢1mol/L NaOH”¢0.01 mol/L KMnO4”¢äåĖ®”¢µķ·Ū-KI”¢Ę·ŗģµČČÜŅŗ”£
ȔɣĮæĪüŹÕŅŗÓŚŹŌ¹ÜÖŠ£¬µĪ¼Ó3mol/L H2SO4ÖĮČÜŅŗ³ŹĖįŠŌ£¬Č»ŗó½«ĖłµĆČÜŅŗ·ÖÖĆÓŚa”¢b”¢cČżÖ§ŹŌ¹ÜÖŠ£¬·Ö±š½ųŠŠĻĀĮŠŹµŃ锣ĒėĶź³ÉĻĀ±ķ£ŗ
ŠņŗÅ | ²Ł ×÷ | æÉÄܳöĻÖµÄĻÖĻó | ½įĀŪ |
¢Ł | ĻņaŹŌ¹ÜÖŠµĪ¼Ó¼øµĪ ČÜŅŗ | ČōČÜŅŗĶŹÉ« | Ōņ¼ŁÉč1³ÉĮ¢ |
ČōČÜŅŗ²»ĶŹÉ« | Ōņ¼ŁÉč2»ņ3³ÉĮ¢ | ||
¢Ś | ĻņbŹŌ¹ÜÖŠµĪ¼Ó¼øµĪ ČÜŅŗ | ČōČÜŅŗĶŹÉ« | Ōņ¼ŁÉč1»ņ3³ÉĮ¢ |
ČōČÜŅŗ²»ĶŹÉ« | ¼ŁÉč2³ÉĮ¢ | ||
¢Ū | ĻņcŹŌ¹ÜÖŠµĪ¼Ó¼øµĪ ČÜŅŗ | ¼ŁÉč3³ÉĮ¢ |
”¾“š°ø”æ£Ø1£©±„ŗĶŹ³ŃĪĖ®£Ø2·Ö£©SiO2+2C+2Cl2![]() SiCl4+2CO£Ø2·Ö£©
SiCl4+2CO£Ø2·Ö£©
£Ø2£©·ĄÖ¹Éś³ÉĪļÖŠźĄAlCl3”¢FeCl3µČŌÓÖŹÄż½į³É¹ĢĢå¶ĀČūµ¼¹Ü£Ø2·Ö£©
£Ø3£©”¾Ģį³ö¼ŁÉč”æ¼ŁÉč3£ŗÖ»ÓŠClO-£Ø2·Ö£©
”¾Éč¼Ę·½°ø£¬½ųŠŠŹµŃé”æ¢ŁäåĖ®£Ø»ņ0.01 mol/L KMnO4ČÜŅŗ£©£Ø1·Ö£©
¢ŚĘ·ŗģČÜŅŗ£Ø1·Ö£© ¢Ūµķ·Ū-KIČÜŅŗ£Ø1·Ö£© ČōČÜŅŗ±äĪŖĄ¶É«£Ø1·Ö£©
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©B”¢CÖŠ·Ö±šĪŖ±„ŗĶŹ³ŃĪĖ®ŗĶÅØĮņĖįÓĆĄ“³żČ„ĀČĘųÖŠµÄHClŗĶĖ®ÕōĘų£»ĀČĘų¾¹ż³żŌÓŗóŌŚDÖŠŗĶSiO2 ÓėCŌŚ¼ÓČČĢõ¼žĻĀ½ųŠŠ·“Ӧɜ³ÉSiCl4ŗĶCO£¬·“Ó¦»Æѧ·½³ĢŹ½ĪŖSiO2+2C+2Cl2![]() SiCl4+2CO£»
SiCl4+2CO£»
£Ø2£©ŹÆӢɰ֊µÄĢś”¢ĀĮµČŌÓÖŹŅ²ÄÜ×Ŗ»ÆĪŖĻąÓ¦ĀČ»ÆĪļ£¬Čōµ¼¹Ü½ĻĻøŹ¹ŌÓÖŹÄż½į³É¹ĢĢå¶ĀČūµ¼¹Ü£»
£Ø3£©ÓɼŁÉč1ŗĶ¼ŁÉč2µĆÖŖ£¬ŅŖ¼ģ²āµÄĪŖSO32-ŗĶClO££¬¹Ź¼ŁÉč3ĪŖÖ»ÓŠClO££»ÓÖŅņĪŖSO32-»įŹ¹KMnO4ŗĶäåĖ®ĶŹÉ«£¬²¢²»ÓėClO£·¢Éś·“Ó¦£¬¹ŹæÉŅŌÓĆĄ“¼ģ²ā¼ŁÉč1£¬¶ųSO32-ŗĶClO£¾ł¾ßÓŠĘư׊Ō£¬»įŹ¹Ę·ŗģČÜŅŗĶŹÉ«£¬¹ŹæÉŅŌÓĆĄ“¼ģ²ā¼ŁÉč2£»ĖłÓŠŹŌ¼ĮÖŠClO£æÉŅŌŃõ»ÆKIŹ¹ĘäÉś³ÉI2£¬ŌŚµķ·ŪČÜŅŗÖŠĻŌĄ¶É«£¬æÉŅŌÓĆĄ“¼ģ²ā¼ŁÉč3”£


 ĘŚÄ©³å“Ģ100·Ö““ŠĀ½š¾ķĶźČ«ŹŌ¾ķĻµĮŠ“š°ø
ĘŚÄ©³å“Ģ100·Ö““ŠĀ½š¾ķĶźČ«ŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓŠ¹ŲĢģČ»²śĪļĖ®½āµÄŠšŹö²»ÕżČ·µÄŹĒ£Ø £©
A£®ĻĖĪ¬ĖŲĖ®½āÓėµķ·ŪĖ®½āµĆµ½µÄ×īÖÕ²śĪļ²»Ķ¬
B£®µ°°×ÖŹĖ®½āµÄ×īÖÕ²śĪļ¾łĪŖ°±»łĖį
C£®æÉÓƵā¼ģŃéµķ·ŪĖ®½āŹĒ·ńĶźČ«
D£®ÓĶÖ¬Ė®½āæɵƵ½±ūČż“¼
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŗćĪĀŗćČŻĢõ¼žĻĀ£¬½«4molAŗĶ2molB·ÅČėŅ»ĆܱÕČŻĘ÷ÖŠ2A(g)+B(g)![]() 2C(g)+D(s)£¬“ļµ½Ę½ŗāŹ±£¬CµÄĢå»ż·ÖŹżĪŖa£»ŌŚĻąĶ¬Ģõ¼žĻĀ£¬°“ĻĀĮŠÅä±Č·Ö±šĶ¶·ÅA”¢B”¢C”¢D£¬“ļµ½Ę½ŗāŹ±£¬CµÄĢå»ż·ÖŹż²»µČÓŚaµÄŹĒ( )
2C(g)+D(s)£¬“ļµ½Ę½ŗāŹ±£¬CµÄĢå»ż·ÖŹżĪŖa£»ŌŚĻąĶ¬Ģõ¼žĻĀ£¬°“ĻĀĮŠÅä±Č·Ö±šĶ¶·ÅA”¢B”¢C”¢D£¬“ļµ½Ę½ŗāŹ±£¬CµÄĢå»ż·ÖŹż²»µČÓŚaµÄŹĒ( )
A£®4mol”¢2mol”¢0mol”¢2mol
B£®2mol”¢1mol”¢2mol”¢2mol
C£®2mol”¢1mol”¢2mol”¢1mol
D£®2mol”¢1mol”¢0mol”¢1mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ“ĪĮ×Ėį(H3PO2)ŹĒŅ»ÖÖ¾«ĻøĮ׻ƹ¤²śĘ·£¬ŹōÓŚŅ»ŌŖČõĖį£¬¾ßÓŠ½ĻĒæµÄ»¹ŌŠŌ”£ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ
A£®ÓƶčŠŌµē¼«µē½āNaH2PO2ČÜŅŗ£¬ĘäŃō¼«·“Ó¦Ź½ĪŖ£ŗ2H2O-4e- =O2”ü+4H+
B£®H3PO2Óė¹żĮæNaOHČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗH3PO2+3OH-=PO23-+3H2O
C£®½«H3PO2ČÜŅŗ¼ÓČėµ½ĖįŠŌÖŲøõĖį¼ŲČÜŅŗÖŠ£¬H3PO2µÄ»¹Ō²śĪļæÉÄÜĪŖH3PO4
D£®H3PO2ČÜÓŚĖ®µÄµēĄė·½³ĢŹ½ĪŖH3PO2![]() H++ H2PO2-
H++ H2PO2-
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1)ĄķĀŪÉĻ½²£¬ČĪŗĪ×Ō·¢µÄŃõ»Æ»¹Ō·“Ó¦¶¼æÉŅŌÉč¼Ę³ÉŌµē³Ų£¬ĒėĄūÓĆ·“Ó¦”°Cu +2Ag+![]() 2Ag + Cu2+”±Éč¼ĘŅ»øö»Æѧµē³Ų(Õż¼«²ÄĮĻÓĆĢ¼°ō£©£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
2Ag + Cu2+”±Éč¼ĘŅ»øö»Æѧµē³Ų(Õż¼«²ÄĮĻÓĆĢ¼°ō£©£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
¢ŁøƵē³ŲµÄøŗ¼«²ÄĮĻŹĒ £»
¢ŚČōµ¼ĻßÉĻ×ŖŅʵē×Ó2.5mol£¬ŌņÕż¼«Éś³ÉŅų æĖ”£
£Ø2£©ĻÖÓŠA”¢B”¢C”¢DĖÄÖÖ½šŹōʬ£¬¢Ł°ŃA”¢BÓƵ¼ĻßĮ¬½ÓŗóĶ¬Ź±½žČėĻ”ĮņĖįČÜŅŗÖŠ£¬A ÉĻÓŠĘųÅŻ²śÉś£»¢Ś°ŃC”¢DÓƵ¼ĻßĮ¬½ÓŗóĶ¬Ź±ĒÖČėĻ”ĮņĖįČÜŅŗÖŠ£¬D·¢Éś»¹Ō·“Ó¦£»¢Ū°Ń A”¢CÓƵ¼ĻßĮ¬½ÓŗóĶ¬Ź±½žČėĻ”ĮņĖįČÜŅŗÖŠ£¬µē×ÓĮ÷¶Æ·½ĻņĪŖA”śµ¼Ļß”śC”£øł¾ŻÉĻŹöĒéæö£¬»Ų“šĻĀĮŠĻņĢā
¢ŁŌŚ¢ŁÖŠ£¬½šŹōʬ ·¢ÉśŃõ»Æ·“Ó¦
¢ŚŌŚ¢ŚÖŠ£¬½šŹōʬ ×÷øŗ¼«£¬
¢ŪČē¹ū°ŃB”¢DÓƵ¼ĻßĮ¬½ÓŗóĶ¬Ź±ĒÖČėĻ”ĮņĖįČÜŅŗ£¬Ōņ½šŹōʬ ÉĻÓŠĘųÅŻ²śÉś”£
¢ÜÉĻŹöĖÄÖÖ½šŹōµÄ»ī¶ÆĖ³ŠņŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ»ÆŗĻĪļ·Ö×ÓÖŠ£¬ŌŚŗĖ“Ź²ÕńĒāĘ×Ķ¼ÖŠÄÜøų³öŅ»ÖÖŠÅŗÅµÄŹĒ£Ø £©
A. CH3CH2CH3 B. CH3COCH2CH3 C. CH3CH2OH D. CH3OCH3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ·“Ó¦4NH3(g)£«5O2(g)£½4NO(g)£«6H2O(g)ŌŚ10LµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬°ė·ÖÖÓŗó£¬Ė®ÕōĘųµÄĪļÖŹµÄĮæŌö¼ÓĮĖ0.45mol£¬Ōņ“Ė·“Ó¦µÄĘ½¾łĖŁĀŹv(x)(·“Ó¦ĪļµÄĻūŗÄĖŁĀŹ»ņ²śĪļµÄÉś³ÉĖŁĀŹ)æɱķŹ¾ĪŖ
A. v(NH3)£½0.010mol/(L”¤s)
B. v(O2)£½0.0010mol/(L”¤s)
C. v(NO)£½0.0010mol/(L”¤s)
D. v(H2O)£½0.045mol/(L”¤s)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijČÜŅŗÖŠÓÉĖ®µēĄė³öĄ“µÄc(OH-) =l0-12moL/L£¬ŌņøĆČÜŅŗÖŠµÄČÜÖŹ²»æÉÄÜŹĒ £Ø £©
A£®HC1 B£®NaOH C£®NH4C1 D£®H2SO4
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ[Ń”ŠŽ3£ŗĪļÖŹ½į¹¹ÓėŠŌÖŹ]
øł¾ŻŌŖĖŲÖÜĘŚ±ķÖŠµŚĖÄÖÜĘŚŌŖĖŲµÄĻą¹ŲÖŖŹ¶£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©µŚĖÄÖÜĘŚŌŖĖŲµÄ»łĢ¬Ō×ӵĵē×ÓÅŲ¼ÖŠ4s¹ģµĄÉĻÖ»ÓŠ1øöµē×ÓµÄŌŖĖŲÓŠ____________ÖÖ£»Š“³öCu+µÄŗĖĶāµē×ÓÅŲ¼Ź½____________”£
£Ø2£©°“µē×ÓÅŲ¼£¬æɽ«ÖÜĘŚ±ķĄļµÄŌŖĖŲ»®·Ö³ÉĪåøöĒųÓņ£¬µŚĖÄÖÜĘŚŌŖĖŲÖŠŹōÓŚsĒųµÄŌŖĖŲÓŠ_________ÖÖ£¬ŹōÓŚdĒųµÄŌŖĖŲÓŠ____________ÖÖ”£
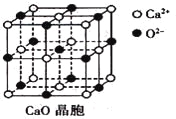
£Ø3£©CaO¾§°ūČēĻĀĶ¼ĖłŹ¾£¬CaO¾§ĢåÖŠCa2+µÄÅäĪ»ŹżĪŖ____________£»
£Ø4£©ÓɵžµŖ»Æ¼Ų(KN3)ČČ·Ö½āæɵƓæN2£ŗ2KN3(s)=2K(l)+3N2(g)£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ________(ĢīŃ”Ļī×ÖÄø£©”£
A£®NaN3ÓėKN3½į¹¹ĄąĖĘ£¬Ē°Õß¾§øńÄܽĻŠ” |
B£®¾§Ģå¼ŲµÄ¾§°ū½į¹¹ČēĶ¼ĖłŹ¾£ŗ |
C£®µŖµÄµŚŅ»µēĄėÄÜ“óÓŚŃõ |
D£®µŖĘų³£ĪĀĻĀŗÜĪČ¶Ø£¬ŹĒŅņĪŖµŖµÄµēøŗŠŌŠ” |
£Ø5£©¶žŃõ»ÆīŃ(TiO2)ŹĒ³£ÓƵĔ¢¾ßÓŠ½Ļøߓ߻ƻīŠŌŗĶĪČ¶ØŠŌµÄ¹ā“߻ƼĮ”£O2ŌŚĘä“ß»Æ×÷ÓĆĻĀ£¬æɽ«CN-Ńõ»Æ³ÉCNO-”£CN-µÄµē×ÓŹ½ĪŖ___________£¬CNO-µÄÖŠŠÄŌ×ÓµÄŌӻƷ½Ź½ĪŖ___________”£
£Ø6£©ŌŚCrCl3ČÜŅŗÖŠ£¬Ņ»¶ØĢõ¼žĻĀ“ęŌŚ×é³ÉĪŖ[CrCln(H2O)6£n]x£«(nŗĶx¾łĪŖÕżÕūŹż£©µÄÅäĄė×Ó£¬½«ĘäĶعżĒāĄė×Ó½»»»Ź÷Ö¬£ØR£H)£¬æÉ·¢ÉśĄė×Ó½»»»·“Ó¦£ŗ
[CrCln(H2O)6£n]x£«+xR-H”śRx[CrCln(H2O)6£n]+xH+”£
½«ŗ¬0.0015mol[CrCln(H2O)6£n]x£«µÄČÜŅŗ£¬ÓėR£HĶźČ«½»»»ŗó£¬ÖŠŗĶÉś³ÉµÄH£«ŠčÅضČĪŖ0.1200 mol/LNaOHČÜŅŗ25.00 mL£¬ŌņøĆÅäĄė×ӵĻÆѧŹ½ĪŖ_____________________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com