
【题目】A、B、C、D、E为原子序数依次增大的五种前四周期元素。A的核外电子总数与其周期数相同;B的价电子排布式为nsnnpn+2;短周期元素C和D为同周期不相邻的元素,C是同周期元素中离子半径最小的元素,D元素最外层有两个未成对电子;E位于元素周期表的第四周期第IVB族,常用加热ECl4(氯化物)溶液的方法制备纳米材料。回答下列问题:
(1)D元素在周期表中的位置为______,E原子核外有_____个未成对电子,五种元素中电负性最大的是_____(填元素名称)。
(2)由A、B、D三种元素形成的常见三元化合物中具有强氧化性的是______(填化学式)。
(3)氯元素能与C(非碳元素符号)形成某化合物Q。在1.01×105Pa、T1℃时,气体摩尔体积为53.4L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的结构式为___________。(如有配位键须用“→”标出)
(4)A、B、D元素形成的化合物有A2B、DB3,下列关于A2B和DB3的说法中,正确的是________(填标号)。
A.中心原子的价层电子对数目相等 B.都是非极性分子
C.中心原子的孤电子对数目相等 D.都含有极性键
E.都能与Na2O反应 F.固态时晶体类型不同
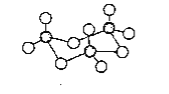
(5)D在空气中燃烧的产物分子构型为_________。固体DB3中存在如图所示的三聚分子,该分子中D原子的杂化轨道类型为________。
(6)E单质有两种同素异形体,高温下是体心立方堆积;但在常温下的晶体结构为如下图所示的六方最密堆积(底面是正六边形)。已知常温下晶体晶胞参数分别为a cm和c cm,则该晶体的密度可表示为________g·cm-3。(用含a和c的式子表示,用NA表示阿伏伽德罗常数的值)。

【答案】第三周期第VIA族 2 氧 H2SO4 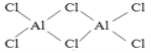 D E V形 sp3
D E V形 sp3 ![]()
【解析】
A、B、C、D、E为原子序数依次增大的五种前四周期元素。B的价电子排布式为nsnnpn+2,n=2则为2s22p4,即B为O元素;A的核外电子总数与其周期数相同且原子序数小于B,则A为H元素;短周期元素C和D为同周期,应为第三周期,C是同周期元素中离子半径最小的元素,则为Al元素,D元素最外层有两个未成对电子,则为S元素;E位于元素周期表的第四周期第IVB族,常用加热ECl4(氯化物)溶液的方法制备纳米材料,则E为Ti元素。
(1)D为S元素,在周期表中的位置为第三周期第VIA族,E为Ti元素,基态原子电子排布式为[Ar]3d24s2,原子核外有2个未成对电子,元素非金属性越强电负性越大,则五种元素中电负性最大的是氧(注意填名称);
(2)由A、B、D三种元素形成的常见三元化合物可以是H2SO3、H2SO4等,具有强氧化性的是H2SO4;
(3)氯元素能与C(非碳元素符号)形成某化合物Q,根据铝和氯的化合价可设Q为(AlCl3)n,在1.01×105Pa、T1℃时,气体摩尔体积为53.4L/mol,实验测得Q的气态密度为5.00g/L,则M=ρVm=5.00g/L×53.4L/mol=267g/mol,则133.5n=267,解得n=2,此时Q的化学式为Al2Cl6,则此时Q的结构式为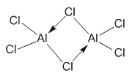 ;
;
(4)A、B、D元素形成的化合物有A2B、DB3分别是H2O、SO3。
A.H2O中O价层电子对数=2+1/2(6-2×1)=4,而SO3中S价层电子对数=3+1/2(6-3×2)=3,因而中心原子的夹层电子对数目不相等,A错误;
B.水分子为非极性分子,而三氧化硫分子为极性分子,B错误;
C.水分子中O原子有2个孤电子对,三氧化硫分子中S原子不存在孤对电子,C错误;
D.极性键指不同原子间形成的共价键,H2O中含两个氧氢键,SO3中含硫氧键,均为极性键,D正确;
E.H2O与Na2O反应得到NaOH,而SO3和Na2O反应得到Na2SO4,E正确;
F.由于H2O和SO3均为分子,固体时晶体类型同为分子晶体,F错误。
故答案选DE。
(5)D在空气中燃烧的产物分子式SO2,S原子最外层6e-,考虑杂化时O原子不提供电子,故6/2=3应该是sp2杂化,又S原子只连有2个原子,故为V形分子(折线形),固体SO3如图所示,S原子为为边缘颜色较深的小球,其与四个O原子连接,根据空间构型与杂化的关系可知,S原子采取sp3杂化。
(6)如图所示,底边正六边形面积=6×![]() ×
×![]() ×acm2,则晶胞体积V=
×acm2,则晶胞体积V=![]() a2c cm3,Ti的摩尔质量为48g/mol,上下底边顶点Ti原子一个晶胞占有
a2c cm3,Ti的摩尔质量为48g/mol,上下底边顶点Ti原子一个晶胞占有![]() ,共有12×
,共有12×![]() =2,上下底边面上中心Ti原子一个晶胞占有
=2,上下底边面上中心Ti原子一个晶胞占有![]() ,共有2×
,共有2×![]() =1,晶胞内有3个Ti,为晶胞所完全占有,因而晶胞内共有2+1+3=6个Ti原子,因而晶胞Ti质量m=
=1,晶胞内有3个Ti,为晶胞所完全占有,因而晶胞内共有2+1+3=6个Ti原子,因而晶胞Ti质量m=![]() g,密度=
g,密度=![]() =
=![]() g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】如图所示。若关闭阀门Ⅰ,打开阀门Ⅱ,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭阀门Ⅱ,打开阀门Ⅰ,再通入这种气体,布条褪色。甲瓶中所盛的试剂可能是( )
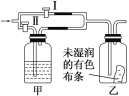
①浓硫酸 ②饱和氯化钠溶液 ③亚硫酸钠溶液 ④饱和碳酸氢钠溶液
A.①②③B.②③④
C.①②④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是( )
A.用20mL量筒量取15mL 酒精,加水5mL,配制质量分数为75%酒精溶液
B.在200mL 某硫酸盐溶液中,含有1.5NA个硫酸根离子,同时含有NA个金属阳离子,不考虑水解问题,则该硫酸盐的物质的量浓度为2.5mol·L1
C.实验中需用2.0mol·L1的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别为 1000mL、201.4g
D.实验室配制500mL0.2mol·L1的硫酸亚铁溶液,其操作是:用天平称15.2g绿矾(FeSO4·7H2O),放入小烧杯中加水溶解,转移到500mL容量瓶,洗涤、稀释、定容、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.由铜、锌作电极与硫酸溶液组成的原电池中,溶液中的H+向正极移动
B.钢铁发生腐蚀时,正极上发生的反应为Fe-2e-=Fe2+
C.铜锌原电池工作时,若有13 g锌被溶解,溶液中就有0.4 mol电子通过
D.原电池必须有两个活泼性不同的金属作电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白黎芦醇具有抗氧化和预防心血管疾病的作用,下列有关白黎芦醇的说法正确的是
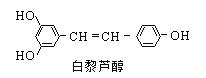
A.白黎芦醇能与NaHCO3溶液反应
B.分子中共含有8种化学环境不同的氢原子
C.1 mol白黎芦醇最多能与7 mol氢气加成
D.1 mol白黎芦醇最多能反应溴水中的3.5 molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白黎芦醇具有抗氧化和预防心血管疾病的作用。可通过以下方法合成:


⑴化合物A中所含官能团的名称为______和______。
⑵由F→G的反应类型是______。
⑶D的结构简式为______。
⑷写出同时满足下列条件的C的一种同分异构体的结构简式:______。
①能发生银镜反应,与FeCl3溶液不显色;
②能发生水解反应,水解产物之一能与FeCl3溶液显色;
③分子中含有4种不同化学环境的氢。
⑸请写出以苯甲酸、甲醇为原料制备![]() 的合成路线流程图,无机试剂可任选,合成示例见本题题干。_________________
的合成路线流程图,无机试剂可任选,合成示例见本题题干。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解AgNO3溶液,说法不正确的是( )
A.电解过程中阴极质量不断增加
B.电解过程中溶液的pH不断降低
C.此时向溶液中加入适量的Ag2O固体可使溶液恢复到电解前的状况
D.电解后两极产生的气体体积比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Co(NH3)5BrSO4可形成两种钴的配合物,已知两种配合物的分子式分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br,分别向两种配合物的溶液中加BaCl2溶液,有白色沉淀产生的是_____。
(2)向CuSO4溶液中逐滴加入稀氨水,所得配合物的化学式为_____,该配合物中存在的化学键类型为_________。
(3)铁可形成多种配位化合物,但与氨形成的化合物不稳定,如FeCl2虽然可以与氨气形[Fe(NH3)6]Cl2,但此物质遇水即生成灰白色沉淀,写出对应的反应方程式:_____。[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol·L-1·min-1。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol·L-1·min-1。求:
(1)5 min后B的浓度c(B)=________mol·L-1,反应开始前容器中的A、B的物质的量:n(A)=n(B)=________mol。
(2)A的平均反应速率:v(A)=________mol·L-1·min-1。
(3)x的值为________。
(4)下列叙述能表明该反应已达平衡状态的是_________(填序号)。
①A的物质的量浓度不变
②3v正(A)=v逆(B)
③混合气体总物质的量不变
④反应物和生成物同时存在,反应体系中四种物质的物质的量均相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com