
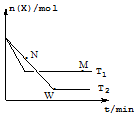
 一定温度下,向某密闭容器中通入X,发生反应:4X(g)?2Y(g)+Z(g)△H,在温度分别为T1、T2 的条件下X的物质的量n(X) 随时间t的变化曲线如图所示.下列有关叙述错误的是( )
一定温度下,向某密闭容器中通入X,发生反应:4X(g)?2Y(g)+Z(g)△H,在温度分别为T1、T2 的条件下X的物质的量n(X) 随时间t的变化曲线如图所示.下列有关叙述错误的是( )| A. | △H<0 | |
| B. | 平衡时Z的产率:T2<T1 | |
| C. | M、N、W三点对应的混合气体的平均相对分子质量:W>M>N | |
| D. | M点的正反应速率大于N点的逆反应速率 |
分析 A.由图可知,T1>T2,温度高时X的物质的量大,则升高温度平衡逆向移动;
B.由图可知,X越小,正向进行的程度越大;
C.气体的总质量不变,正向进行程度越大,混合气体的物质的量越小;
D.M点达到平衡,N点正反应速率大于逆反应速率.
解答 解:A.由图可知,T1>T2,温度高时X的物质的量大,则升高温度平衡逆向移动,该反应为放热反应,△H<0,故A正确;
B.由图可知,X越小,正向进行的程度越大,则平衡时Z的产率:T2>T1,故B错误;
C.气体的总质量不变,正向进行程度越大,混合气体的物质的量越小,X越小,正向进行的程度越大,则混合气体的平均相对分子质量:W>M>N,故C正确;
D.M点达到平衡,N点正反应速率大于逆反应速率,则M点的正反应速率大于N点的逆反应速率,故D正确;
故选B.
点评 本题考查物质的量随时间的变化曲线,为高频考点,把握图中物质的量变化、温度对反应的影响为解答的关键,侧重分析与应用能力的考查,注意图象与平衡移动的结合,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知在一定温度下,各反应的平衡常数如下:
(1)已知在一定温度下,各反应的平衡常数如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与Cl2加成(1,2-二氯乙烷) | |
| B. | 乙烯与水加成(乙醇) | |
| C. | 氢气与苯催化剂加热的条件下发生的反应(环己烷) | |
| D. | 氯气与甲烷按照比例2:1在光照条件下反应(二氯甲烷) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题:
某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com