
����Ŀ����50 mL NaOH��Һ����������ͨ��һ������CO2�����ȡ����Һ10 mL����ϡ����100 mL�������ϡ�ͺ����Һ����μ���0.1 mol��L-1��HCl��Һ������CO2������������״��������������������֮��Ĺ�ϵ����ͼ��ʾ��
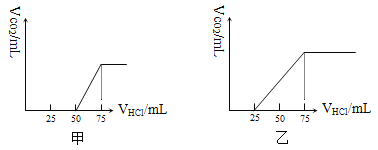
��1������Һ�е�������_____________�������ʵ���֮��Ϊ__________________��
��2������Һ�е�������_____________���ڱ�״��������CO2��������Ϊ________��
��3��ԭNaOH��Һ�����ʵ���Ũ��Ϊ ��
���𰸡���1��NaOH��Na2CO3��2�֣� 1:1��2�֣�
��2��Na2CO3��NaHCO3 ��2�֣� 112ml��2�֣���3��0.75 mol/L��1�֣�
��������
�����������1��������CO2����ʱ��������ӦNaHCO3+HCl=NaCl+H2O+CO2������ͼ��֪������CO2�������������HClΪ75mL����������̼��NaOH��Ӧ����Һ��ֻ��Na2CO3����Na2CO3+HCl=NaHCO3+NaCl��֪����Na2CO3ת��ΪNaHCO3Ӧ����HClΪ25mL����ͼ���п�ʼ����CO2����ʱ����HCl���Ϊ50mL��˵���ýλ�������Ӧ��NaOH+HCl=NaCl+H2O����Һ������ΪNaOH��Na2CO3���к�NaOH����HCl�����Ϊ50mL��25mL=25mL���ɷ���ʽ��֪NaHCO3��Na2CO3�����ʵ���֮�ȵ����������̷ֱ�������������֮�ȣ���NaOH��Na2CO3�����ʵ���֮��=25mL��25mL=1��1��Ũ��֮����1��1��
��2�����еڶ������ĵ�����࣬��˵����Һ�е�������̼���ƺ�̼�����ơ����ɶ�����̼��������50mL���ᣬ����NaHCO3+HCl=NaCl+H2O+CO2������֪CO2�������״���£�Ϊ0.05L �� 0.1 mol/L �� 22.4 L/mol = 0.112L = 112mL��
��3������CO2�������ʱ����ʱ��Һ������ΪNaCl�����������ӡ��������غ��֪n��NaOH��=n��NaCl��=n��HCl��=0.075L��0.1mol/L=0.0075mol����ԭ����������Һ��Ũ��=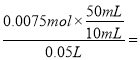 0.75mol/L��
0.75mol/L��


 ��ѧ��ʦ����ϵ�д�
��ѧ��ʦ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ع㷺Ӧ���ھ�ˮ����ع�ҵ������ҵ�����Ѱ������ĸ���ƷFeSO4�Ʊ�������ص������������£�

�����ϵ�֪K2FeO4��һЩ���ʣ�
���ڼ��Ի������ȶ��������Ժ����������²��ȶ���
����ˮ���ܽ�Ⱥܴ���������ˮ�Ҵ����л��ܼ���
�ش��������⣺
��1��д������I�У�����Fe3+�����ӷ�Ӧ����ʽ��
��2������II�У��Լ�AΪ ���H2O2����HNO3����NaC1O��������Ӧ�����ӷ���ʽΪ_____________________��
��3������I�а�����ȴ�ᾧ������ϴ�ӡ����X�����裬ϴ�Ӹ����Ŀ�����Ѽ���ˮ������ϴ�Ӳ���ʱӦ���� ϴ�ӡ�
��4����ˮʱ�������������ˮ��Ӧ������״��Fe��OH��3���벹�䲢��ƽ�÷�Ӧ����ʽ��ϵ�������
______K2FeO4 + H2O ![]() Fe��OH��3��������+ KOH + ��
Fe��OH��3��������+ KOH + ��
��һ������K2FeO4Ͷ��һ��Ũ�ȵ�FeC13��Һ�У����ʣ��K2FeO4Ũ������ͼ��ʾ���Ʋ��������I������II�����ԭ����: ��

��5���ƵõĴ�K2FeO4��Ʒ�г���������KCl��ȡ5.0 g�ֲ�Ʒ��������ϡ���ᣬ��ַ�Ӧ���������������������˵õ�������ϴ�ӡ���������õ�1.435 g���壬K2FeO4����������Ϊ___________���������õ������ԭ��������O 16 Cl 35.5 K 39 Fe 56 Ag 108��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�����������ȷ���ǣ� ��
A. ʵ����ʣ��ҩƷӦ�Ż�ԭ�Լ�ƿ��
B. �и����ʱӦ����ˮ�½���
C. ��ij������Һ��pHʱ������ˮ��pH��ֽʪ��
D. �������������������ʵ�ȥ����ʵ���У����������е���Һֱ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��100g���ʵ���Ũ��Ϊ18mol/L���ܶ�Ϊ��g/mL��Ũ�����У�����һ������ˮϡ��Ϊ9mol/L���� ����Һ�������ˮ�������
A������100mL B����100mL C������100mL D������100/�� mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1.12g���ۼ���25mL 2molL��1���Ȼ�����Һ�У���ַ�Ӧ�������ǣ� ��
A������ʣ�࣬��Һ��dz��ɫ��Cl��Ũ�Ȼ�������
B������Һ�е�����ɫKSCN��Һ���Ի�ɫ
C��Fe2+��Fe3+�����ʵ���֮��Ϊ6��1
D�����������뻹ԭ��������ʵ���֮��Ϊ2��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йؽ�������;���������õ��ǽ����Ļ�ѧ���ʵ���( )
A��ͭ�������� B�����������侵
C��������������Һ�е��� D���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к��зḻ�ĵ⡣Ϊ�˴Ӻ�������ȡ�⣬ij�о���ѧϰС����Ʋ�����������ʵ�飺
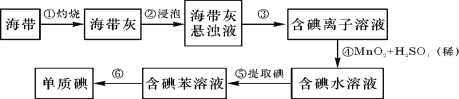
��1�������������п�֪�������к��еĵ�Ԫ�ص���Ҫ������ʽ�� (�ѧʽ)��
��2�����������պ���ʱ������Ҫ���żܡ��������⣬����Ҫ�õ���ʵ�������� (������������ѡ��������������ñ����ĸ��д�ڿհ״�)��
A�ձ� B������ C���� D�ƾ��� E������
��3���������ǴӺ��ⱽ��Һ�з�������ʵ�ͻ��ձ������辭������ָ��ʵ��װ���еĴ���֮����
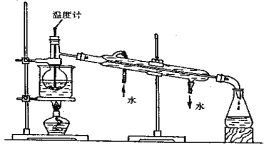
�� ���� ���� ��
���������������ʱ��ʹ��ˮԡ��ԭ���� �����̬���� ��ۼ���
��4����������Ӧ�����ӷ���ʽ�� �����õ����е�KIO3������������������Һ������I����д����Ӧ�����ӷ���ʽ ��
��5�����麣�����Ƿ��е�Ԫ�أ������ڲ���������У�����ʱ���õ��Լ��� ��
��6���������У�ijѧ��ѡ���ñ�����ȡ�⣬��ʵ������ɷֽ�Ϊ���¼�����
(A)��ʢ����Һ�ķ�Һ©����������̨����Ȧ�У�
(B)��50������ˮ��15�����������Һ©����,���Ǻò�������
(C)�����Һ©���������ϿڵIJ������Ƿ�©Һ��
(D)��ת©������������ʱ�����������������رջ������ѷ�Һ©��������
(E)��������,���ձ�������Һ��
(F)����Һ©���Ͽڵ����ϲ���Һ��
(G)��©���ϿڵIJ�������ʹ���ϵİ��ۻ�С��©�����ϵ�С�ף�
(H)���ã��ֲ㡣
�ʹ�ʵ��,���������գ�
��ȷ���������˳���� �� �� ��A��G�� ��E��F
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ֲ�����ڣ�������Ļ�ѧԪ�غͺ�������Ԫ�طֱ���
A. C��O B. O��H C. C�� H D. H��O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��������ֽ����������֯���Ƹ����ҵ����Ҫԭ�ϡ���ҵ̼����(����Լ98%)�к���Ca2����Mg2����Fe3����Cl����SO42�������ʣ��ᴿ�����������£�
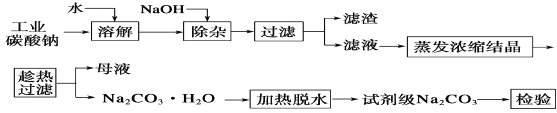
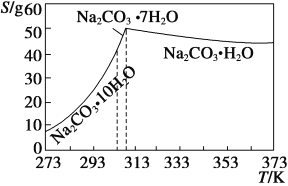
��֪̼���Ƶ��ܽ��(S)���¶ȱ仯����������ͼ��ʾ��
�ش�����������
��1����������Ҫ�ɷ�Ϊ_______________________________��
��2�������ȹ�������ԭ����___________________________��
��3������ʵ���ҽ��������ȹ��������ɲ�ȡ�Ĵ�ʩ��_____(д��һ��)��
��4����֪��Na2CO3��10H2O (s)===Na2CO3(s)��10H2O(g) ��H1�� +532.36 kJ��mol��1
Na2CO3��10H2O(s)===Na2CO3��H2O(s)��9H2O(g) ��H2�� +473.63 kJ��mol��1
д��Na2CO3��H2O��ˮ��Ӧ���Ȼ�ѧ����ʽ____________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com