
【题目】实验室以含银废液{主要含[Ag(NH3)2]+、[Ag(S2O3)2]3-}为原料制取硝酸银晶体,其实验流程如下:

已知:①“沉银”所得AgCl中含有少量PbCl2、Ag2S。
②Zn2+在浓氨水中以[Zn(NH3)4]2+形式存在。
③PbCl2、AgNO3的溶解度曲线如图所示:

(1)“滤液”中的主要阳离子为___(填化学式)。
(2)“除杂”分为两步:先除去PbCl2,再除去Ag2S。
①在不同温度下,AgCl、Ag2S均难溶于水。 除去PbCl2的操作为______,热水洗涤。
②向热水洗涤所得固体中加入浓硝酸和稀盐酸,边加热边充分搅拌,使Ag2S转变为AgCl。加入浓硝酸的目的是_______。
(3)室温下,可逆反应AgCl+2NH3·H2O[Ag(NH3)2]++Cl-+2H2O的平衡常数K=___。{Ksp(AgCl)= 1.8×10-10,Ag++2NH3·H2O[Ag(NH3)2]++2H2O的平衡常数为1.1×107}
(4)“还原”过程中发生反应的离子方程式为_____ 。
(5)粗银经水洗后,经多步处理可制备硝酸银晶体。请补充完整由以水洗后粗银为原料,制备硝酸银晶体的实验方案:________,过滤,________,将产生的气体和空气混合后通入NaOH溶液进行尾气处理,将所得AgNO3溶液_______,过滤,将所得晶体置于烘箱 (120℃)干燥,密封包装。(实验中须使用的试剂:稀硫酸、稀硝酸、BaC12溶液)
【答案】NH4+ 热水溶解,趁热过滤 将Ag2S中S2-氧化 ![]()
![]() 将水洗后所得粗银溶于过量得稀硫酸中 洗涤至最后一次洗涤液中加入BaCl2溶液无现象,向滤渣中加入过量稀硝酸充分反应 加热浓缩、冷却结晶
将水洗后所得粗银溶于过量得稀硫酸中 洗涤至最后一次洗涤液中加入BaCl2溶液无现象,向滤渣中加入过量稀硝酸充分反应 加热浓缩、冷却结晶
【解析】
由实验流程可知,含银废液{主要含[Ag(NH3)2]+、[Ag(S2O3)2]3-}与浓盐酸反应生成AgCl(含有少量PbCl2、Ag2S)和滤液,然后除去杂质PbCl2、Ag2S,将AgCl溶于浓氨水中,再利用过量的Zn置换Ag,将水洗后所得粗银溶于过量得稀硫酸中,过滤,滤渣加入过量稀硝酸充分反应,将所得AgNO3溶液,加热浓缩、冷却结晶,得到硝酸银晶体,以此分析。
(1)含银废液{主要含[Ag(NH3)2]+、[Ag(S2O3)2]3-}与浓盐酸发生反应:![]() ,
,![]() ,则滤液中主要阳离子为NH4+,
,则滤液中主要阳离子为NH4+,
故答案为:NH4+;
(2)根据溶解度曲线可知PbCl2的溶解度随着温度的升高而增大,则除去PbCl2的操作为热水溶解,趁热过滤,热水洗涤;利用浓硝酸可以氧化S2-使沉淀平衡正移,再加入稀盐酸,生成AgCl沉淀,则除去Ag2S的操作为向热水洗涤所得固体中加入浓硝酸和稀盐酸,边加热边充分搅拌,使Ag2S转变为AgCl,
故答案为:热水溶解,趁热过滤;将Ag2S中S2-氧化;
(3)![]() 的平衡常数K,=1.1×107,Ksp(AgCl)= 1.8×10-10,则反应AgCl+2NH3·H2O[Ag(NH3)2]++Cl-+2H2O的平衡常数
的平衡常数K,=1.1×107,Ksp(AgCl)= 1.8×10-10,则反应AgCl+2NH3·H2O[Ag(NH3)2]++Cl-+2H2O的平衡常数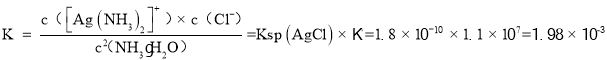 ,
,
故答案为:![]() ;
;
(4)Zn与银氨溶液反应方程式为:![]() ,
,
故答案为:![]() ;
;
(5)粗银中含有少量的Zn,以水洗后粗银为原料,制备硝酸银晶体的实验方案为:将水洗后所得粗银溶于过量得稀硫酸中,过滤,洗涤至最后一次洗涤液中加入BaCl2溶液无现象,向滤渣中加入过量稀硝酸充分反应,将产生的气体和空气混合后通入NaOH溶液进行尾气处理,将所得AgNO3溶液热浓缩、冷却结晶,将所得晶体置于烘箱 (120℃)干燥,密封包装。
故答案为:将水洗后所得粗银溶于过量得稀硫酸中;洗涤至最后一次洗涤液中加入BaCl2溶液无现象,向滤渣中加入过量稀硝酸充分反应;加热浓缩、冷却结晶。


科目:高中化学 来源: 题型:
【题目】物质X在一定条件下可转化为物质Y或物质Z:
![]()
![]()
两个反应的能量变化如图所示,下列说法正确的是
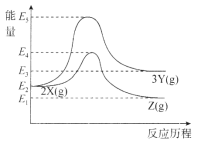
A.两个反应均为放热反应
B.X、Y、Z的关系是互为同素异形体或同分异构体
C.X转化为Y的活化能高于X转化为Z的活化能
D.其它条件一定,加压有利于提高X转化为Z的速率和平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法中正确的是 ( )
A. 常温常压下,0.05 NA个CO2分子所占的体积是1.12 L
B. 1 mol氧气含有氧原子数为NA
C. 常温常压下,32g氧气和34 g H2S分子个数比为1∶1
D. 标准状况下,NA个水分子所占的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 可用于工业上制备 Na2S2O3。下列化学用语表示正确的是
A.中子数为20的硫原子:![]() S
S
B.Na+的结构示意图: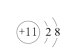
C.Na2S的电子式:![]()
D.CO32-水解的离子方程式 CO32-+2H2O=H2CO3+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4是一种常见的还原剂。一种以H2、Na、硼酸三甲酯[B(OCH3)3]为原料,生产NaBH4的工艺流程如下:
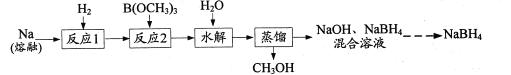
(1)下列措施能提高“反应1”的化学反应速率的有______(填字母)。
A.充分搅拌熔融钠
B.将熔融钠充分分散在石蜡油中
C.反应前排尽装置中的空气
(2)在浓硫酸作用下,B(OCH3)3可由B(OH)3和CH3OH发生酯化反应制得。浓H2SO4的作用是_____。
(3)“反应2”在240℃条件下进行,生成的产物是NaBH4和CH3ONa,写出该反应的化学方程式:____ 。“反应2”所用B(OCH3)3需充分干燥,原因是______。
(4)反应NaBH4+2H2O=NaBO2+4H2 可用于制取H2。一定浓度的NaBH4催化制氢的半衰期(溶液中NaBH4消耗一半时所需的时间)与溶液pH的关系如图所示:
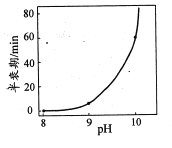
①NaBH4与水反应所得溶液呈碱性,原因是____。
②随着反应的进行,生成H2的速率逐渐减慢,原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池己被广泛用作便携式电源。正极材料为LiCoO2、LiFePO4等,负极材料一般为石墨碳,以溶有LiPF6、LiBF4等的碳酸二乙酯(DEC)作电解液。
(1)Fe2+基态核外电子排布式为 ________。
(2)PO43-的空间构型为 ________ (用文字描述)。
(3)![]() 中
中![]() 的配位数为6,该配合物中的配位原子为 _____。
的配位数为6,该配合物中的配位原子为 _____。
(4)碳酸二乙酯(DEC)的分子结构如图所示,分子中碳原子的轨道杂化类型为_____,1mol碳酸二乙酯(DEC)中含有σ键的数目为_____。
![]()
(5)氮化锂是一种新型无机贮氢材料,其晶胞结构如图所示,该晶体的化学式为_______。
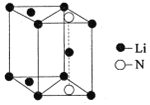
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是
A. 分液漏斗可以分离甘油和水的混合物
B. 分子式为C5H10Cl2,结构中含有一个-CH3的同分异构体有7种
C. 由甲苯制取三硝基甲苯的反应与乙酸和苯甲醇反应的类型不同
D. 有机物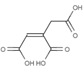 能发生氧化、还原、加成、加聚和取代反应
能发生氧化、还原、加成、加聚和取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是
A. 12 g金刚石中含有化学键的数目为4NA
B. 18 g的D2O中含有的质子数为10
C. 28 g的乙烯和环已烷混合气体中所含原子总数为6NA
D. 1 L 1mol·L1的NH4Cl溶液中NH4+和Cl―的数目均为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应Zn+H2SO4=ZnSO4+H2↑,1 mol Zn反应时放出Q kJ热量。下列叙述不正确的是( )
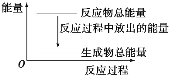
A.反应过程中的能量关系可用如图表示B.滴入少许CuSO4溶液后反应速率减小
C.若将该反应设计成原电池,则锌为负极D.理论上当转移4 mol电子时放出2QkJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com