
·ÖĪö £Ø1£©°±Ė®ŅÖÖĘĮĖĖ®µÄµēĄė£¬°±Ė®ÖŠĒāĄė×ÓŹĒĖ®µēĄėµÄ£¬¾Ż“ĖæÉÖŖČÜŅŗÖŠĒāĄė×ÓÅØ¶Č£¬ŌŁøł¾ŻpH=-lgc£ØH+£©¼ĘĖć³öpH£»
£Ø2£©ĻČĄūÓĆpH=-lgc£ØH+£©¼ĘĖćpH=12µÄĒāŃõ»ÆÄĘČÜŅŗµÄc£ØH+£©£¬øł¾ŻKw=c£ØH+£©•c£ØOH-£©=1”Į10-14£¬¼ĘĖćc£ØOH-£©£¬Ļ”ŹĶ100±¶ŗó£¬Ēó³öc£ØOH-£©£¬ŌŁøł¾ŻKw=c£ØH+£©•c£ØOH-£©=1”Į10-14£¬¼ĘĖćČÜŅŗÖŠc£ØH+£©£¬ĄūÓĆpH=-lgc£ØH+£©¼ĘĖć£»
£Ø3£©pH=3µÄH2SO4ČÜŅŗÖŠĒāĄė×ÓµÄĪļÖŹµÄĮæÅضČĪŖ0.001mol/L£¬pH=12µÄNaOHČÜŅŗÖŠĒāŃõøłĄė×ÓµÄĪļÖŹµÄĮæÅضČĪŖ£ŗ10-2mol/L£»µ±»ģŗĻČÜŅŗµÄpH=10Ź±£¬ČÜŅŗ³Ź¼īŠŌ£¬¼“ĒāŃõ»ÆÄĘ¹żĮ棬¾Ż“ĖĮŠŹ½¼ĘĖć£®
£Ø4£©Čē¹ūČÜŅŗÖŠQc£¾Ksp[Mg£ØOH£©2]¾ĶÄܲśÉś³Įµķ£¬øł¾Żc£ØOH-£©=$\sqrt{\frac{{K}_{SP}}{C£ØM{g}^{2+}£©}}$¼ĘĖć£®
½ā“š ½ā£ŗ£Ø1£©Ä³ÅØ¶ČµÄNH3•H2OČÜŅŗÖŠµÄĒāĄė×ÓŹĒĖ®µēĄėµÄ£¬Ņ²ŹĒČÜŅŗÖŠĒāĄė×ÓÅØ¶Č£¬¼“ČÜŅŗÖŠc£ØH+£©=1”Į10-13mol/L£¬ŌņČÜŅŗµÄpH=13£¬
¹Ź“š°øĪŖ£ŗ13£»
£Ø2£©pH=-lgc£ØH+£©£¬pH=11µÄĒāŃõ»ÆÄĘČÜŅŗµÄc£ØH+£©=1”Į10-11£¬c£ØOH-£©=$\frac{{K}_{W}}{C£Ø{H}^{+}£©}$=10-3£¬
Ļ”ŹĶ100±¶ŗó£¬c£ØOH-£©=1”Į10-5mol/L£¬c£ØH+£©=$\frac{1{0}^{-14}}{1{0}^{-5}}$=1”Į10-9mol/L£¬
ĖłŅŌøĆČÜŅŗµÄpH=-lg£Ø1”Į10-9£©=9£¬
¹Ź“š°øĪŖ£ŗ9£»
£Ø3£©PH=-lgc£ØH+£©=3µÄH2SO4ČÜŅŗc£ØH+£©=0.001mol/L£¬½«pH=12µÄNaOHČÜŅŗÖŠc£ØOH-£©=0.01mol/L£¬ČōĖłµĆ»ģŗĻČÜŅŗµÄpH=10£¬Ōņ·“Ó¦ŗóµÄČÜŅŗµÄc£ØOH-£©=$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L=0.0001£Ømol/L£©£¬
Ōņc£ØOH-£©=$\frac{0.01mol/L”Į{V}_{¼ī}-0.001mol/L”Į{V}_{Ėį}}{{V}_{Ėį}+{V}_{¼ī}}$=0.0001mol/L£¬
½āµĆ£ŗVĖį£ŗV¼ī=9£ŗ1£¬
¹Ź“š°øĪŖ£ŗ9£ŗ1£»
£Ø4£©Ksp[Mg£ØOH£©2]=c£ØMg2+£©”Įc2£ØOH-£©£¬Čē¹ūČÜŅŗÖŠQc£¾Ksp[Mg£ØOH£©2]¾ĶÄܲśÉś³Įµķ£¬c£ØOH-£©=$\sqrt{\frac{{K}_{SP}}{C£ØM{g}^{2+}£©}}$=$\sqrt{\frac{3.2”Į1{0}^{-11}}{0.02}}$=4”Į10-5 mol/L£¬
¹Ź“š°øĪŖ£ŗ4”Į10-5£®
µćĘĄ ±¾Ģāæ¼²éĮĖČÜŅŗpHµÄ¼ĘĖć·½·Ø”¢ÄŃČÜĪļµÄČܽāĘ½ŗāÓŠ¹Ų¼ĘĖć£¬ĢāÄæÄѶČÖŠµČ£¬²ąÖŲæ¼²é¼ĘĖćÄÜĮ¦£¬×¢ŅāÕĘĪÕpHµÄ±ķ“ļŹ½¼°¼ĘĖć·½·Ø£¬Ć÷Č·ČܶȻż³£Źż”¢ČÜŅŗĖį¼īŠŌÓėČÜŅŗpHµÄ¹ŲĻµĪŖ½ā“š¹Ų¼ü£¬ŹŌĢāÓŠĄūÓŚÅąŃųѧɜµÄ»Æѧ¼ĘĖćÄÜĮ¦£®


 µ¼Ń§½Ģ³ĢøßÖŠŠĀæĪ±źĻµĮŠ“š°ø
µ¼Ń§½Ģ³ĢøßÖŠŠĀæĪ±źĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
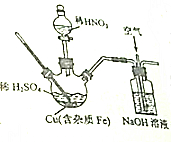 Į×ĖįĶæÉÓĆ×÷¶ĘĶĄė×ÓĢķ¼Ó¼Į£¬ŹµŃéŹŅŌŚČēĶ¼ĖłŹ¾×°£Ø¼Š³Ö”¢¼ÓČČ×°ÖĆŹ”Č„Ī“»£©ÄŚ·“Ӧɜ³ÉĮĖĮņĖįĶŗĶÉŁĮæĮņĖįĢś£¬ŌŁ½ųŅ»²½“ÓĖłµĆČÜŅŗÖŠ»ńµĆĮņĖįĶ¾§Ģ壬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
Į×ĖįĶæÉÓĆ×÷¶ĘĶĄė×ÓĢķ¼Ó¼Į£¬ŹµŃéŹŅŌŚČēĶ¼ĖłŹ¾×°£Ø¼Š³Ö”¢¼ÓČČ×°ÖĆŹ”Č„Ī“»£©ÄŚ·“Ӧɜ³ÉĮĖĮņĖįĶŗĶÉŁĮæĮņĖįĢś£¬ŌŁ½ųŅ»²½“ÓĖłµĆČÜŅŗÖŠ»ńµĆĮņĖįĶ¾§Ģ壬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
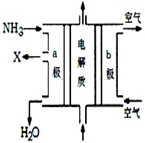
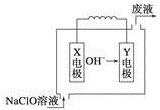 Č¼ĮĻµē³Ų¾ßÓŠÄÜĮæ×Ŗ»ÆĀŹøß”¢ĪŽĪŪČ¾µČĢŲµć£¬ĻĀĶ¼ĪŖMg-NaClOČ¼ĮĻµē³Ų½į¹¹Ź¾ŅāĶ¼£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
Č¼ĮĻµē³Ų¾ßÓŠÄÜĮæ×Ŗ»ÆĀŹøß”¢ĪŽĪŪČ¾µČĢŲµć£¬ĻĀĶ¼ĪŖMg-NaClOČ¼ĮĻµē³Ų½į¹¹Ź¾ŅāĶ¼£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A£® | µē³Ų¹¤×÷Ź±£¬Na+Ļņøŗ¼«ŅĘ¶Æ | |
| B£® | Ć¾×÷Yµē¼« | |
| C£® | ·ĻŅŗµÄpH“óÓŚNaClOČÜŅŗµÄpH | |
| D£® | Xµē¼«ÉĻ·¢ÉśµÄ·“Ó¦ĪŖClO-+2H2O-4e-ØTClO3-+4H+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | H+”¢Na+”¢CO32- | B£® | Ba2+”¢SO42-”¢Cl- | C£® | K+”¢H+”¢OH- | D£® | Ag+”¢Al3+”¢NO3- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | COµÄČ¼ÉÕČČĪŖ283 kJ | |
| B£® | Ķ¼æɱķŹ¾ÓÉCOÉś³ÉCO2µÄ·“Ó¦¹ż³ĢŗĶÄÜĮæ¹ŲĻµ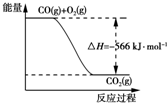 | |
| C£® | 2Na2O2£Øs£©+2CO2£Øs£©ØT2Na2CO3£Øs£©+O2£Øg£©”÷H=-452 kJ•mol-1 | |
| D£® | CO£Øg£©ÓėNa2O2£Øs£©·“Ó¦·Å³ö509 kJČČĮæŹ±£¬µē×Ó×ŖŅĘŹżĪŖ1.204”Į1024 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µČÖŹĮæµÄ¶žŃõ»ÆĮņŗĶ°±Ęų£¬Ē°ÕßĢå»ż“ó | |
| B£® | ±źæöĻĀ22.4Éż HClĶØČėĖ®ÖŠČÜŅŗÖŠŗ¬ĀČ»ÆĒā·Ö×ÓĪŖ0.1 mol | |
| C£® | ČĪŗĪĢõ¼žĻĀĻąĶ¬ĪļÖŹµÄĮæµÄĮ½ÖÖĘųĢåŗ¬ÓŠĻąĶ¬ŹżÄæµÄ·Ö×Ó | |
| D£® | ±źæöĻĀ2 molH2µÄĦ¶ūÖŹĮæŹĒ4g/mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ŅŌĻĀŹĒ¶Ō»Æѧ·“Ó¦±ä»Æ¹ż³Ģ¼°½į¹ūµÄŃŠ¾æ£®°“ŅŖĒó»Ų“šĪŹĢā£ŗ
ŅŌĻĀŹĒ¶Ō»Æѧ·“Ó¦±ä»Æ¹ż³Ģ¼°½į¹ūµÄŃŠ¾æ£®°“ŅŖĒó»Ų“šĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com