
 活性炭,杂质元素有铁、镁、铝、硅、铜等)中提取海棉钯(含Pd>99.9%)的部分工艺流程如下:
活性炭,杂质元素有铁、镁、铝、硅、铜等)中提取海棉钯(含Pd>99.9%)的部分工艺流程如下: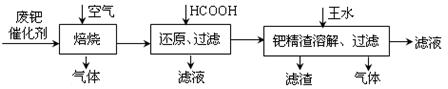
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
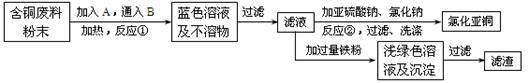
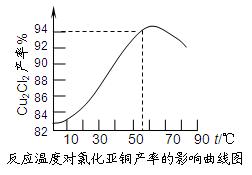
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
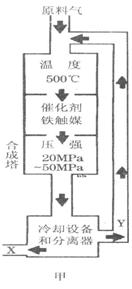
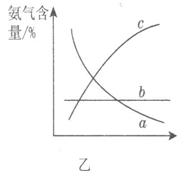
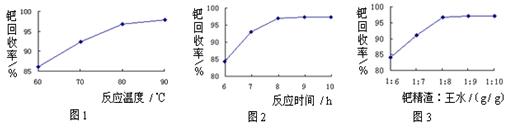
 ②图甲中条件选定的主要原因是(选填字母序号,下同)________。
②图甲中条件选定的主要原因是(选填字母序号,下同)________。 某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
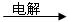 A + B + C
A + B + C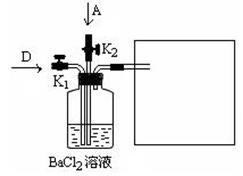
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
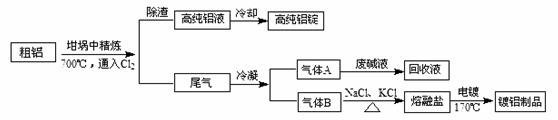
 :NaCl熔点为801℃;AlCl3在181℃升华)
:NaCl熔点为801℃;AlCl3在181℃升华)查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.采用原煤脱硫技术,可减少燃煤产生的SO2 | B.硅酸钠的水溶液俗称水玻璃,可用作木材防腐剂 |
| C.水晶既不溶于水也不溶于任何酸 | |
| D.水泥、玻璃都是硅酸盐制品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com