

| ||
| W1g |
| amol/L×2b×10-3L |
| 6 |
| ||
| W1g |
| ||
| W1g |
| ||
| W1g |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
| A、Cu+AgNO3→Cu(NO3)2 | |||||
| B、Cu+HNO3(稀)→Cu(NO3)2 | |||||
| C、Cu+HNO3(浓)→Cu(NO3)2 | |||||
D、Cu
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子 | B、单质 | C、元素 | D、分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、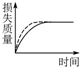 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸乙酯中混有乙酸,可选用饱和Na2CO3溶液洗涤,然后将两层液体分开 |
| B、在提纯鸡蛋中的蛋白质时,可向鸡蛋清溶液中加入浓(NH4)2SO4溶液,然后将所得沉淀滤出,即得较纯的蛋白质 |
| C、油脂提纯中,可将油脂加入浓NaOH溶液中加热,然后过滤,滤出的溶液即为较纯的油脂 |
| D、甘蔗是制备蔗糖的主要原料,榨出的甘蔗汁因含色素而呈棕黄色,在制取蔗糖前应先加入适量的活性炭,搅拌、过滤、蒸发结晶,即得较纯的蔗糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com