
按要求回答下列问题:
(1)实验室中常用NaOH溶液来进行洗气和提纯,当100mL 3mol/L的NaOH溶液吸收标准状况下4.48L CO2时,所得溶液中各离子浓度由大到小的顺序为
(2)常温下向一定体积的0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是 。
A.溶液中导电粒子的数目减少
B醋酸的电离程度增大,c(H+)亦增大
C.溶液中 不变
不变
D溶液中 减小
减小
(3)①常温下将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2= (溶液体积变化忽略不计)。
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是
A.若反应后溶液呈中性,则
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.lmol/L的下列五种溶液的PH值如表所示:

①根据表中数据,将浓度均为0.01 mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是 。

(5)几种离子开始沉淀时的pH如下表:

当向含相同浓度 离子的溶液中滴加NaOH溶液时,
(填离子符号)先沉淀,
离子的溶液中滴加NaOH溶液时,
(填离子符号)先沉淀, (填“>”、“二”或“<”)。
(填“>”、“二”或“<”)。
(1)c(Na+)>c(HCO3—)>c(CO32—)>c(OH—)>c(H+);(2)CD;(3)①1∶1;②AD;(4)①A;②AB;(5)Cu2+,<。
【解析】
试题分析:(1)实验室中常用NaOH溶液来进行洗气和提纯,当100mL 3mol/L的NaOH溶液吸收标准状况下4.48L CO2时,所得溶液为等浓度的碳酸钠和碳酸氢钠的混合液,水解显碱性,且碳酸根的水解程度大于碳酸氢根,各离子浓度由大到小的顺序为c(Na+)>c(HCO3—)>c(CO32—)>c(OH—)>c(H+);(2)常温下向一定体积的0.1 mol/L醋酸溶液中加水稀释,醋酸的电离平衡正向移动,A、溶液中导电粒子的数目增多,错误;B、醋酸的电离程度增大,但溶液的体积增大,c(H+)减小,错误;C、加水稀释,溶液的温度不变,醋酸的电离常数和水的离子积常数不变,溶液中Ka/kw=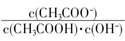 不变,正确;D、加水稀释,溶液中水的电离程度增大,溶液中
不变,正确;D、加水稀释,溶液中水的电离程度增大,溶液中 减小,正确;(3)①常温下将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则有(0.3V1-0.1V2)·10-3=0.1(V1+V2)·10-3,可得V1∶V2=1∶1;②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得, A.若反应后溶液呈中性,则溶液中c(H+)=c(OH-)=1×10-7 mol•L-1,所以溶液M中c(H+)+c(OH-)=2×10-7 mol•L-1,正确;B.如果二者体积相等,如果酸是强酸,则混合溶液呈中性,如果酸是弱酸,则混合溶液呈酸性,错误;C.若反应后溶液呈酸性,则溶液是酸和盐溶液,若酸是弱酸,酸浓度大于氢氧化钠浓度,所以V1不一定大于V2,错误;D.若反应后溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液,则V1一定小于V2,正确;选AD;(4)根据题给数据及盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大,溶液的碱性越强判断,酸性强弱顺序是CH3COOH>H2CO3>HClO>HCN>HCO3—,①根据表中数据,将浓度均为0.01 mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是HCN,选A;②根据强酸制弱酸规律判断,下列反应可以成立的是AB;(5)当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,溶液中氢氧根的浓度逐渐增大,所需氢氧根浓度越小的离子越先沉淀,即pH小的离子先沉淀,溶度积常数越小的物质越先沉淀,所以Cu2+先沉淀,KSP[(Fe(OH)2]<KSP[(Mg(OH)2]。
减小,正确;(3)①常温下将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则有(0.3V1-0.1V2)·10-3=0.1(V1+V2)·10-3,可得V1∶V2=1∶1;②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得, A.若反应后溶液呈中性,则溶液中c(H+)=c(OH-)=1×10-7 mol•L-1,所以溶液M中c(H+)+c(OH-)=2×10-7 mol•L-1,正确;B.如果二者体积相等,如果酸是强酸,则混合溶液呈中性,如果酸是弱酸,则混合溶液呈酸性,错误;C.若反应后溶液呈酸性,则溶液是酸和盐溶液,若酸是弱酸,酸浓度大于氢氧化钠浓度,所以V1不一定大于V2,错误;D.若反应后溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液,则V1一定小于V2,正确;选AD;(4)根据题给数据及盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大,溶液的碱性越强判断,酸性强弱顺序是CH3COOH>H2CO3>HClO>HCN>HCO3—,①根据表中数据,将浓度均为0.01 mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是HCN,选A;②根据强酸制弱酸规律判断,下列反应可以成立的是AB;(5)当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,溶液中氢氧根的浓度逐渐增大,所需氢氧根浓度越小的离子越先沉淀,即pH小的离子先沉淀,溶度积常数越小的物质越先沉淀,所以Cu2+先沉淀,KSP[(Fe(OH)2]<KSP[(Mg(OH)2]。
考点:考查电解质溶液,涉及弱电解质的电离、盐类的水解及沉淀溶解平衡。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
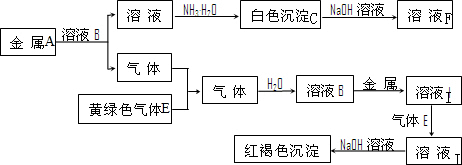
 A、B、C、D都是由短周期元素组成的常见物质,其中A、B、C均含同一种元素,在一定条件下相互转化关系如图所示(部分产物已略去).
A、B、C、D都是由短周期元素组成的常见物质,其中A、B、C均含同一种元素,在一定条件下相互转化关系如图所示(部分产物已略去).| 催化剂 |
| △ |
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 H++CN-、H2O
H++CN-、H2O H++OH-、CN-+H2O
H++OH-、CN-+H2O HCN+OH-
HCN+OH- H++CN-、H2O
H++CN-、H2O H++OH-、CN-+H2O
H++OH-、CN-+H2O HCN+OH-
HCN+OH-查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com