

 、B
、B 、C
、C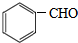 、F
、F ;
; $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +2H2O.
+2H2O. 分析 A的分子式为C9H10O3;A中不饱和度=$\frac{9×2+2-10}{2}$=5,苯环的不饱和度是4,A、E都能与碳酸钠反应产生二氧化碳,则A的结构简式为 ,A发生消去反应生成B,B为
,A发生消去反应生成B,B为 ,A、E是同分异构体,则B和水发生加成反应生成E,E为
,A、E是同分异构体,则B和水发生加成反应生成E,E为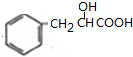 ,E失去两分子水生成F,F是含有三个六元环的化合物,F为
,E失去两分子水生成F,F是含有三个六元环的化合物,F为 ;K、I是酯化反应的产物,B生成的C和D都是醛,C、D被氧化生成G、H,G、H是羧酸,K中含有16个C原子、4个O原子,则G、A以1:1反应生成K,则C为
;K、I是酯化反应的产物,B生成的C和D都是醛,C、D被氧化生成G、H,G、H是羧酸,K中含有16个C原子、4个O原子,则G、A以1:1反应生成K,则C为 ,G为
,G为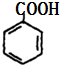 ,D为OHCCHO,H为HOOCCOOH,K为
,D为OHCCHO,H为HOOCCOOH,K为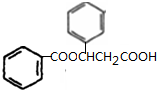 ,H和A以1:2反应生成I,I为
,H和A以1:2反应生成I,I为 ,据此分析解答.
,据此分析解答.
解答 解:A的分子式为C9H10O3;A中不饱和度=$\frac{9×2+2-10}{2}$=5,苯环的不饱和度是4,A、E都能与碳酸钠反应产生二氧化碳,则A的结构简式为 ,A发生消去反应生成B,B为
,A发生消去反应生成B,B为 ,A、E是同分异构体,则B和水发生加成反应生成E,E为
,A、E是同分异构体,则B和水发生加成反应生成E,E为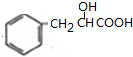 ,E失去两分子水生成F,F是含有三个六元环的化合物,F为
,E失去两分子水生成F,F是含有三个六元环的化合物,F为 ;K、I是酯化反应的产物,B生成的C和D都是醛,C、D被氧化生成G、H,G、H是羧酸,K中含有16个C原子、4个O原子,则G、A以1:1反应生成K,则C为
;K、I是酯化反应的产物,B生成的C和D都是醛,C、D被氧化生成G、H,G、H是羧酸,K中含有16个C原子、4个O原子,则G、A以1:1反应生成K,则C为 ,G为
,G为 ,D为OHCCHO,H为HOOCCOOH,K为
,D为OHCCHO,H为HOOCCOOH,K为 ,H和A以1:2反应生成I,I为
,H和A以1:2反应生成I,I为 ,
,
(1)根据上面的分析,A为 ,B为
,B为 ,C为
,C为 ,F为
,F为 ,
,
故答案为: ;
; ;
; ;
; ;
;
(2)H→I的化学方程式为HOOCCOOH+2 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +2H2O,
+2H2O,
故答案为:HOOCCOOH+2 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +2H2O.
+2H2O.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断以及知识综合应用能力,正确判断A结构简式是解本题关键,再结合反应条件、生成物分子式或结构特点进行推断,难点是同分异构体判断,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 标况下,1mol的NH3 | B. | 4℃时,18克水 | ||
| C. | 2mol的Al(密度为2.7g•cm-3) | D. | 常温常压下1mol的CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各种物质的量/mol | 达到平衡时体系能量的变化 | |||
| n(A) | n(B) | n(C) | n(D) | ||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8kJ |
| ② | 0 | 0 | 1 | 4 | 放出热量:Q1 |
| ③ | 1 | 1 | 2 | 1 | 放出热量:Q2 |
| A. | 若容器①中反应10min达到平衡,0~10min时间内,用A表示的平均反应速率v(A)=4.0×10-2mol/(L•min) | |
| B. | 平衡时,①与②容器中A的体积分数相等 | |
| C. | ③达平衡时体系能量的变化主要为热能转化为化学能 | |
| D. | 容器③中,开始时v(B)生成>v(B)消耗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于$\frac{1}{2}$ | B. | 大于$\frac{1}{2}$,小于1 | C. | 等于$\frac{1}{2}$ | D. | 大于1,小于2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火,立即用泡沫灭火器灭火 | |
| B. | 眼睛里溅进盐酸,应立即用大量水冲洗眼睛 | |
| C. | 易燃试剂与强氧化性试剂分开放置并远离火源 | |
| D. | 在气体发生装置上直接点燃氢气时,必须先检验氢气的纯度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溶液稀释到原体积的10倍 | B. | 加入适量的CH3COONa固体 | ||
| C. | 加入等体积0.2 mol•L-1盐酸 | D. | 提高溶液的温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com