
硼与铝的性质相似,能与氧气、氢氧化钠溶液等物质反应。硼与氯气反应生成三氯化硼(BCl3),生成的三氯化硼遇水水解产生白雾(已知:BCl3的熔点为-107.3 ℃,沸点为12.5 ℃),且三氯化硼用于制取乙硼烷(B2H6)。某兴趣小组设计如图所示装置制备三氯化硼。
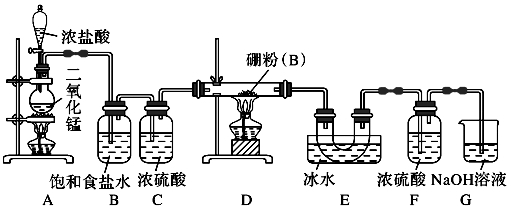
回答下列问题:
(1) 装置D中发生反应的化学方程式为_____________________。
(2)装置B、E的作用分别是_________________________。
(3)可以用盛装___________(填试剂名称)的干燥管代替装置F和G,使实验更简便。
(4)为了顺利完成实验,点燃酒精灯的正确操作是_________(填字母),其理由是_________________。
a.先点燃A处酒精灯,后点燃D处酒精灯
b.先点燃D处酒精灯,后点燃A处酒精灯
c.同时点燃A、D两处酒精灯
科目:高中化学 来源: 题型:选择题
| A. | 19 | B. | 26 | C. | 30 | D. | 45 |
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期第三次月考化学试卷(解析版) 题型:填空题
五种短周期元素A、B、C、D、E的原子序数依次增大,A原子核中无中子且A和C同主族,A和B形成的化合物在水中呈碱性,单质D在单质E中可燃烧产生白色烟雾。回答下列问题:
(1)除B外,上述元素的电负性从大到小依次为 ;(用元素符号表示)
(2)B的氢化物与同主族第三、第四周期所形成的氢化物沸点由高到低的排列顺序是 (用化学式表示),原因是 ;
(3)A和D形成的化合物的中心原子的杂化类型为 ;A和B形成的化合物BA5中存在的化学键类型为 ;
(4)单质D的一种含氧酸可表示为H3DO3,它是二元弱酸,请写出它与足量的氢氧化钠溶液反应的离子方程式____________;
(5)C 的一种氧化物的晶胞结构如图所示,晶胞参数a=0.566 nm,晶胞中C原子的配位数为 ;此晶体的密度(g·cm-3)为 (只列式不计算)。
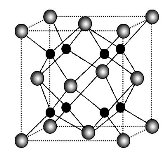
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期第三次月考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.将NO2气体通入NaOH溶液中:3NO2+2OH-=2NO3-+NO↑+H2O
B.将铁丝插入过量的稀硝酸中:Fe+4H++NO3-=Fe3++NO↑+2H2O
C.IBr和Cl2的化学性质相似,将IBr通入NaOH溶液中:IBr+2OH-=I-+BrO-+H2O
D.Na2S溶液通入足量SO2气体:2S2-+SO2+2H2O=3S↓+4OH-
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上月考二化学试卷(解析版) 题型:选择题
向HC1、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是
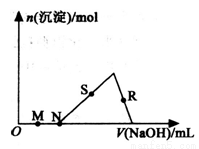
A.M点对应的溶液中:K+、Fe2+、NO3-、SO42-
B.N点对应的溶液中:K+、NH4+、HCO3-、Cl﹣
C.S点对应的溶液中:Na+、Ag+、SO42- 、NO3-
、NO3-
D.R点对应的溶液中:Na+、SO42-、NO3-、Cl﹣
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上月考二化学试卷(解析版) 题型:选择题
在H2SO3+2H2S=3H2O+3S反应中,被氧化与被还原元素的质量比为
A.1:1 B.2:1 C.1:2 D.3:2
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上模拟一化学试卷(解析版) 题型:实验题
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺如下(部分操作和条件略):
Ⅰ.将铬铁矿和碳酸钠混合充分焙烧。
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A。
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B。
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5。
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体。
Ⅰ中焙烧发生的反应如下,配平并填写空缺:
FeO•Cr2O3 + Na 2CO3 + = Na2CrO4 + Fe2O3 + CO2↑;
2CO3 + = Na2CrO4 + Fe2O3 + CO2↑;
②Na2CO3+Al2O3=2NaAlO2+CO2↑。
(2)固体A中主要含有 (填写化学式)。
(3)已知重铬酸钾溶液中存在如下平衡:2CrO42-+2H+ Cr2O72-+H2O。Ⅳ中调节溶液pH<5时,其目的是 。
Cr2O72-+H2O。Ⅳ中调节溶液pH<5时,其目的是 。
(4)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,已知下表数据
物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度 (g/100g水) | 0 | 28 | 35.7 | 4.7 | 163 |
40 | 40.1 | 36.4 | 26.3 | 215 | |
80 | 51.3 | 38 | 73 | 376 | |
①该反应能发生的理由是 。
②获得K2Cr2O7晶体的操作有多步组成,依次是:加入KCl固体、____________、____________、过滤、洗涤、干燥得到晶体。
(5)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加 入过量____________(填写试剂名称)、溶解、过滤、再通入过量的CO2、…灼烧、冷却、称量,得干燥固体m g。计算样品中氢氧化铝的质量分数为____________(用含m、n的代数式表示)。
入过量____________(填写试剂名称)、溶解、过滤、再通入过量的CO2、…灼烧、冷却、称量,得干燥固体m g。计算样品中氢氧化铝的质量分数为____________(用含m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com