
制印刷电路时常用氯化铁溶液作为“腐蚀液”。铜被氯化铁溶液腐蚀的方程式为B2FeCl3+Cu 2FeCl2+CuCl2;FeCl3 溶液也能与铁反应2FeCl3+Fe
2FeCl2+CuCl2;FeCl3 溶液也能与铁反应2FeCl3+Fe 3FeCl2;当向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯底部不可能出现的是
3FeCl2;当向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯底部不可能出现的是
A.有铜无铁 B.有铁无铜 C.有铁有铜 D.无铁无铜
科目:高中化学 来源:2016-2017学年贵州省高一上期中化学卷(解析版) 题型:选择题
下列电离方程式错误的是 ( )
A.NaHCO3 = Na++H++CO32- B.NaHSO4 = Na++H++SO42-
C.Mg(NO3)2 = Mg2++2NO3- D.Na2SO4 = 2Na++SO42-
查看答案和解析>>
科目:高中化学 来源:2017届湖北省八校高三上学期12月联考化学试卷(解析版) 题型:填空题
MnO2用途很广,它是一种广泛应用的氧化剂。例如将它加入熔态的玻璃中,可以除去带色的杂质(硫化物或亚铁盐),称为普通玻璃的“漂白剂”。在锰-锌干电池中用作去极剂,以氧化在电极上产生的氢。
(1)Zn- MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。其电解质溶液呈________性(填“酸”、“碱”或“中”),原因是_________________、________________(用离子方程式表示);该电池工作时,电子流向__________极(填“正”或 “负”)。
(2)工业上,常以菱锰矿(主要成分MnCO3,常含有少量铁、钙、锌等元素)为原料,用电解法可以制备MnO2。其制备过程如下:
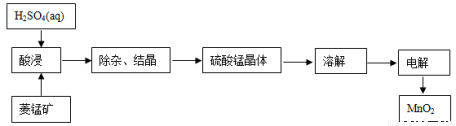
写出酸浸的主要化学方程式:______________________。
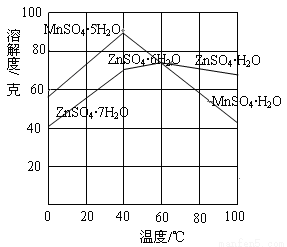
②下图可以看出,从MnSO4和ZnSO4混合溶液中结晶MnSO4·H2O晶体,需要控制的温度范围为______________(填字母)。
A.0~40℃ B.40~60℃ C.60℃以上
③请写出用惰性电极电解MnSO4溶液制备MnO2的阳极反应:___________________。
④该工艺产生的废水中含有较多的Mn2+,通常用H2S或者Na2S溶液处理。25 ℃,在0.10 mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
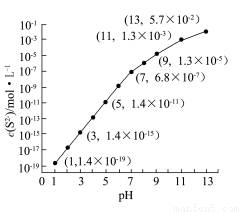
i.pH=13时,溶液中的c(H2S)+c(HS-)=__________mol·L-1;
ii.某溶液含x mol·L-1 Mn2+、0.10 mol·L-1 H2S,当调节溶液pH=5时,Mn2+开始沉淀,则x= 。[已知:Ksp(MnS)=2.8×10-13]
查看答案和解析>>
科目:高中化学 来源:2017届安徽省培优联盟高三冬季联赛化学试卷(解析版) 题型:选择题
常温下.用Na2S沉淀Cu2+、Mn2+、Fe2+、Zn2+四种金属离子(M2+),所需S2-最低浓度的对 数值lgc(S2-)与lgc(M2+)关系如下图所示,下列说法正确的是
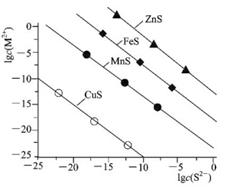
A.室温时.向ZnS悬浊液中加人ZnSO4固体,.Ksp(ZnS)将随之减小
B.Na2S溶液中:c(OH-)<c(H+)+c(HS-)+c(H2S)
C.为除去MnCl2溶液中混有的少量 CuCl2,可加入适量Na2S固体,充分搅拌后过滤
D.向100 mL浓度均为1×10-5mol/L的Fe2+、Zn2+混合溶液中逐滴加入1×10-4mol/LNa2S溶液,Fe2+先沉淀,证明Ksp(FeS)<Ksp(ZnS)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省分校高一上期中化学卷(解析版) 题型:实验题
实验室用固体烧碱配制450mL0.25mol·L-1的CuSO4溶液。
(1)需称量_____________g的CuSO4·5H2O固体。
(2)配制过程中,不需要使用的仪器是(填代号)_____________。
①烧杯②量筒③玻璃棒④1000mL容量瓶⑤漏斗⑥500mL试剂瓶
(3)根据实验的实际需要和(2)中列出的仪器判断,完成实验还缺少的玻璃仪器是__________________ (填仪器名称)。
(4)下列操作使配制出的溶液浓度偏低的是(填编号)____________。
A.称量药品时物码放反 |
B.把溶液转移到容量瓶时有溶液溅出 |
C.转移溶液前容量瓶中有蒸馏水 |
D.定容时仰视读数 |
E.定容时俯视读数
F.定容后发现容量瓶中液体超过标线,用胶头滴管吸出一部分
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省分校高一上期中化学卷(解析版) 题型:选择题
下列反应的离子方程式中,正确的是
A.铜跟稀硫酸反应:Cu+2H+ Cu2++H2↑
Cu2++H2↑
B.浓盐酸跟氢氧化钾溶液反应:H++OH- H2O
H2O
C.向澄清石灰水中通入少量CO2:OH-+CO2 HCO
HCO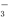
D.碳酸镁跟浓硫酸反应:MgCO3+2H+ Mg2++H2O+CO2↑
Mg2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省分校高一上期中化学卷(解析版) 题型:选择题
下列数量的物质中含原子个数最多的是
A.0.4mol氢气 B.标准状况下5.6L 二氧化碳
C.4℃ 时5.4ml水 D.10g氖
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省分校高二上期中化学卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.标准状况下,22.4L二氯甲烷含有NA个二氯甲烷分子
B.1L 0.1mol/L乙酸溶液中H+数为0.1NA
C.17.6g丙烷中所含的极性共价键为3.2 NA个
D.1mol Na2O2 固体中含离子总数为4 NA
查看答案和解析>>
科目:高中化学 来源:2017四川省自贡市高三第一次诊断考试化学试卷(解析版) 题型:实验题
氰化钠(NaCN)是一种重要的化工原料、有剧毒,一旦泄露可以通过喷洒双氧水或硫代硫酸钠溶液来处理。
已知:氰化钠与硫代硫酸钠的反应为:NaCN+Na2S2O3==NaSCN+Na2SO3回答下列问题:
(1)氰化物中碳的化合价为___________;用硫代硫酸钠处理1mol NaCN时,反应中转移电子的物质的量为 。
(2) NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是 。
(3)某化学兴趣小组在实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】制备Na2S2O3,其实验室装置如下:

b装置的作用是___________;c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有_____________。
实验结束后,在e处最好连接盛____________(填化学式)的注射器,再关闭K2打开K1,以防拆除装置过程中的有害气体污染空气。
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg/L;
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先于Ag+反应。
实验如下:取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
滴定时1.000×10-4mol/L的标准AgNO3溶液应用_________(填仪器名称)盛装;滴定终点时的现象是___________。
处理后的废水是否达到排放标准:__________(填“是”或“否”),其依据是__________(用实验数据说明)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com