
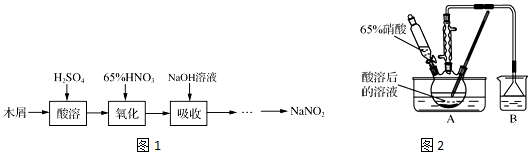
分析 (1)木屑的主要成分是纤维素[(C6H10O5)n],酸溶后得葡萄糖溶液,用葡萄糖还原硝酸得NO和NO2,用NaOH吸收NO和NO2,得到NaNO2;HNO3不稳定,温度过高发生分解,所以反应温度不宜高于60℃,NaOH溶液呈碱性,可以用碳酸钠溶液代替,据此答题;
(2)测定产品纯度,利用KMnO4氧化NO2-进行滴定计算NaNO2的含量,反应过程中高锰酸钾溶液的紫色会褪色,当达到滴定终点时,高锰酸钾溶液的紫色就不会褪色,根据电子得失守恒可得关系式2KMnO4~5NaNO2,根据KMnO4的物质的量,可求得NaNO2的质量,进而确定产品中NaNO2的纯度,据此答题.
解答 解:(1)①根据分析可知,A中有硝酸参加反应,硝酸受热易分解,降低了原料利用率,所以反应温度不宜高于60℃;
故答案为:避免硝酸分解,降低原料利用率;
不经过任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除OH-外还有两种阴离子,其中一种是NO2-,另一种为NO3-,根据反应C6H12O6+12HNO3═3HOOC-COOH+9NO2↑+3NO↑+9H2O可知,得到的NO和NO2的体积比为1:3,根据反应NO+NO2+2NaOH═2NaNO2+H2O,2NO2+2NaOH═NaNO3+NaNO2+H2O可得反应NO+3NO2+4NaOH═3NaNO2+NaNO3+2H2O,所以溶液中NO2-与NO3-的物质的量之比为3:1;
故答案为:3:1;
③NaOH溶液呈碱性,可以用碳酸钠溶液代替;
故答案为:B;
(2)①锥形瓶中发生反应为高锰酸钾氧化亚硝酸钠,反应的离子方程式为5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;
故答案为:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;
②KMnO4的物质的量为cV×10-3 mol,根据反应5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O可知,NaNO2的物质的量为2.5cV×10-3 mol,所以产品中NaNO2的纯度为:$\frac{2.5cV×1{0}^{-3}mol×\frac{100mL}{20mL}×69g/mol}{ag}×100%$;
故答案为:$\frac{2.5cV×1{0}^{-3}mol×\frac{100mL}{20mL}×69g/mol}{ag}×100%$.
点评 本题考查物质制备实验方案设计与探究,为高频考点,把握制备原理、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 稳定性:PH3>H2S>HCl | B. | 碱性:Al(OH)3>Mg(OH)2>NaOH | ||
| C. | 酸性:HIO4>HBrO4>HClO4 | D. | 非金属性:F>O>S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂,化学反应速率加快,反应的△H也随之减小 | |
| B. | 改变压强,平衡不发生移动,反应放出的热量不变 | |
| C. | 升高温度,反应速率加快,反应放出的热量不变 | |
| D. | 若在原电池中进行,反应放出的热量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在“天宫二号”上蚕宝宝的“太空屋”形似胶囊(如图),两端的半球体由航天铝合金打造,中间部分采用透明有机玻璃,蚕宝宝由聚氨酯海绵包裹着.
在“天宫二号”上蚕宝宝的“太空屋”形似胶囊(如图),两端的半球体由航天铝合金打造,中间部分采用透明有机玻璃,蚕宝宝由聚氨酯海绵包裹着.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
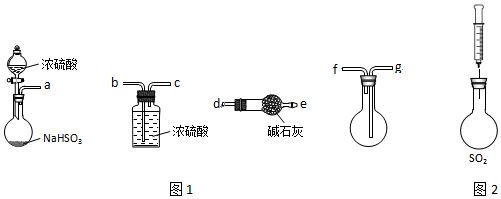
| 操作步骤 | 实验现象 | 解释原因 |
| 用注射器将新制H2S溶液注入充满SO2的烧瓶 | 产生乳白色浑浊 | +4价S有①氧化性 |
| 用注射器将 ②FeCl3溶液溶液注入充满SO2的烧瓶 | ③溶液由棕黄色变成浅绿色 | +4价S有还原性,反应的离子方程式为④2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| Ksp | 10-13 | 10-17 | 10-39 | 10-33 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com