
【题目】常温下,运用电离理论做出的预测正确的是
A.测定某二元弱酸钠盐溶液的pH,可能小于7
B.稀释0.1mol/LCH3COOH(aq),![]() 可能变大也可能变小
可能变大也可能变小
C.在20.00mL浓度均为0.100 mol/L的HCl与CH3COOH混合溶液中滴加0.200mol/LNaOH溶液至pH=7,NaOH溶液体积一定小于20.00mL
D.pH=8的碱性溶液中一定没有CH3COOH分子
【答案】AC
【解析】
A.弱酸的钠盐如果是正盐溶液显碱性,但如果是酸式盐就可能显碱性也可能显酸性,如NaHSO3溶液显酸性,PH小于7,A选项正确;
B.稀释0.1mol/LCH3COOH(aq)时,促进醋酸的电离,溶液中OH-、CHCOO-数目增多,CH3COOH分子数目减少,故![]() 变大,选项B不正确;
变大,选项B不正确;
C.在20.00mL浓度均为0.100mol/L的HCl与CH3COOH混合溶液中滴加0.200mol/LNaOH溶液20.00mL时,恰好中和生成NaCl和CH3COONa的混合溶液,醋酸钠溶液水解使溶液显碱性,若pH=7,NaOH溶液体积一定小于20.00mL,故C正确;
D.CH3COONa溶液显碱性,但存在CH3COO-的水解,故溶液中也存在CH3COOH分子,选项D不正确。
故答案选AC。


科目:高中化学 来源: 题型:
【题目】醋酸亚铬是一种氧气吸收剂, 通常以二水盐[Cr(CH3COO)2]2 ·2H2O(式量:376)的形式存在,难溶于冷水,易溶于盐酸。其制备原理和实验装置:
制备原理:![]()
实验装置:(如图所示)
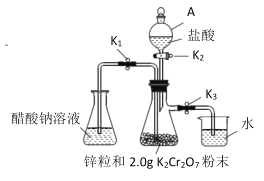
(1)仪器 A 的名称是__________。
(2)装好试剂后按上述装置进行实验,完成下表内容。
操作步骤 | 实验现象 | 发生反应的离子方程式 |
关闭①___________________,打开②_______________,(用K1、K2、K3填写,下同)使盐酸缓慢加入至抽滤瓶中 | 抽滤瓶中锌粒溶解,溶液由橙色逐渐变成蓝色,有少量气泡 | ③________,Zn+2H+=Zn2++H2↑ |
抽滤瓶中产生大量气体时快速加入适量盐酸,关闭K2和④__________________,打开⑤_________ | 抽滤瓶中⑥____________ | Zn+2H+=Zn2++H2↑ |
当溶液完全转移后,迅速塞紧锥形瓶,用冷水冷却 | 锥形瓶中有深红色晶体析出 | ⑦_____________ |
(3)洗涤产品后干燥、称量,得到 1.0g 固体。列式表示产率:____(不必计算出结果,K2Cr2O7 式量:294)。在实验中如果盐酸过量,会导致产率偏________。(填“高”或“低”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素是最重要的金属元素之一,其不仅是各种钢材的主要成分,很多含铁化合物也具有重要意义。
(1)按照电子排布,可把元素周期表中的元素划分成五个区,铁元素属于_________区。
(2)Mn2+在水溶液中难被氧化,而Fe2+则易被氧化为Fe3+ ,请从离子的价电子式角度解释Mn2+与Fe2+还原能力的差别:_________。Mn2+的半径_________ Fe3+的半径(填“>”、“<”或“=”)。
(3)金属铁晶体中铁原子采用体心立方堆积,该铁晶体的空间利用率为_________(用含π的式子表示)。
(4)向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的[Fe(SCN)(H2O)5]2+。N、H、O三种元素的电负性由大到小的顺序为_________;[Fe(SCN)(H2O)5]2+中Fe3+的配位数为_________,H2O中氧原子的杂化方式为_________。
(5)二茂铁是一种含铁的有机化合物,其化学式为Fe(C5H5)2,可看作是Fe2+离子与两个正五边形的环戊二烯负离子(C5H![]() )配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π
)配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则C5H
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则C5H![]() 的大π键表示为________。二茂铁是黄色针状晶体,熔点173 ℃(在100 ℃时开始升华),沸点249 ℃,在水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是________(填标号)。
的大π键表示为________。二茂铁是黄色针状晶体,熔点173 ℃(在100 ℃时开始升华),沸点249 ℃,在水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是________(填标号)。
A 离子键 B 配位键 C σ 键 D 范德华力
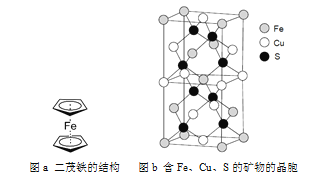
(6)一种含有Fe、Cu、S三种元素的矿物的晶胞(如上图b所示),属于四方晶系(晶胞底面为正方形),晶胞中S原子位于内部,Fe原子位于体心和晶胞表面,Cu原子位于晶胞表面。此矿物的化学式为_________。若晶胞的底面边长为A pm,高为C pm,阿伏伽德罗常数为NA,则该晶体的密度为__________ g/cm3(写出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、N及S的化合物用途非常广泛。回答下列问题;
(1)基态Fe原子价电子排布图为____;基态S原子的核外电子占据最高能级的电子云轮廓图为__________形。
(2)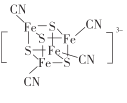 团簇离子中,Fe2+、Fe3+数目之比为______;与铁形成配位键的原子是________,铁的配位数为_________。
团簇离子中,Fe2+、Fe3+数目之比为______;与铁形成配位键的原子是________,铁的配位数为_________。
(3)四氟铵可通过下列反应制备:NF3+F2 + BF3 =NF4 BF4
①NF3的空间构型为_____ , 中心原子的杂化方式是______。
②NF4BF4存在的作用力有________(填字母)。
A. σ键 B. π键 C.离子键. D.配位键
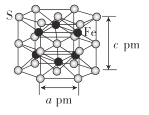
(4)Fe与S形成的一种化合物晶体的结构如图所示,六棱柱底边边长为a pm,高为c pm,阿伏加德罗常数的值为NA,该Fe、S化合物晶体的密度为_____(列出计算式)g. cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C的结构简式是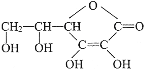 ,它的分子式是______________。由于它能防治坏血病,又称为_______。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有__________性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是___________,说明维生素C具有____________性。
,它的分子式是______________。由于它能防治坏血病,又称为_______。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有__________性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是___________,说明维生素C具有____________性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上常采用甲醇气相脱水法来获取。其反应方程式为:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
完成下列填空:
28、有机物分子中都含碳元素,写出碳原子最外层电子的轨道表示式_______________;
写出甲醇分子中官能团的电子式_________________。
29、碳与同主族的短周期元素相比,非金属性较强的是_________(填元素符号)。写出一个能证明你的结论的化学方程式_____________________________________。
30、在温度和体积不变的情况下,能说明反应已达到平衡状态的是______(选填编号)
a.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
b.容器内压强保持不变
c.H2O(g)浓度保持不变
d.气体平均相对分子质量保持不变
31、一定温度下,在三个体积约为2.0 L的恒容密闭容器中发生上述反应:
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.40 | 0.16 | 0.16 |
Ⅱ | 387 | 0.80 | a | |
Ⅲ | 207 | 0.40 | 0.18 | 0.18 |
(1)若要提高CH3OH的平衡转化率,可以采取的措施是______(选填编号)。
a.及时移走产物 b.升高温度 c.充入CH3OH d.降低温度
(2)I号容器内的反应经过t min达到平衡,则CH3OH的平均反应速率为_____________(用含t的式子表示)。II号容器中a =___________mol。
32、若起始时向容器I中充入CH3OH 0.2mol、CH3OCH3 0.30mol和H2O 0.20mol,则反应将向__________(填“正”“逆”)反应方向进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究用AgNO3溶液将混合溶液中的Cl-和CrO42-沉淀分离,绘制了25℃时AgCl和Ag2CrO4两种难溶化合物的溶解平衡曲线。其中,pAg+= -lgc(Ag+),其余离子类推。两条相交的溶解平衡曲线把图像分成了X、Y、Z、M四个区域。下列说法错误的是( )

A.Ksp(Ag2CrO4)约为1 ×10-12,Ksp(AgCl)的数量级为10-10
B.M区域内可析出Ag2CrO4沉淀,而不析出AgCl沉淀
C.向Cl-、CrO42-均为0.1 mol/ L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀
D.向Ag2CrO4、AgCl混合固体和水的溶解平衡体系中加入少量水, 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学的核心是发生化学反应,利用化学反应合成物质,同时也伴随有能量的变化,下列有关说法中不正确的是( )
A.只要发生化学反应就一定有能量变化
B.Zn+2HCl=ZnCl2+H2↑这是一个放热反应,结论:1molZn和2molHCl的能量之和高于1molZnCl2和1molH2的能量之和
C.反应A+B=C+D的能量变化如图所示,反应物A和B断裂化学键吸收总能量低于形成生成物C和D释放的总能量

D.发生化学反应实现了化学能和其他形式能量之间的相互转化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com