
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源:2017届四川省高三上综合测试三化学卷(解析版) 题型:实验题
某探究小组用KMnO4酸性溶液与H2C2O4溶液反应中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件作如下限定:所用酸性KMnO4溶液的浓度可选择0.010 mol•L-1、0.0010 mol•L-1, 催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.10 mol•L-1)的用量均为4 mL。
(1)写出反应的离子方程式:
(2)请完成以下实验设计表:完成④的实验条件,并将实验目的补充完整。
实验 编号 | T/K | 催化剂的用量 / g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
① | 298 | 0.5 | 0.010 | a. 实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③探究 对反应速率的影响 c. 实验①和④探究催化剂对反应速率的影响。 |
② | 298 | 0.5 | 0.001 | |
③ | 323 | 0.5 | 0.010 | |
④ |
(3)该反应的催化剂选择MnCl2还是MnSO4 ,简述选择的理由 。
(4)某同学对实验①和②分别进行了三次实验,测得以下数据(从混合振荡均匀开始计时):
实验编号 | 溶液褪色所需时间 t / min | ||
第1次 | 第2次[ | 第3次 | |
① | 12.8 | 13.0 | 11.0 |
② | 4.9 | 5.1 | 5.0 |
a、实验②中用KMnO4的浓度变化来表示的平均反应速率为 (忽略混合前后溶液的体积变化)。
b、该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液浓度越小,所需时间就越短,亦即其反应速率越快”的结论,你认为是否正确 (填“是”或“否”)。
C、某同学认为不用经过计算,直接根据褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为应该如何设计实验 。
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上期中化学试卷(解析版) 题型:选择题
某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:

下列有关判断中不正确的是( )
A.溶液A和B均可以是盐酸或NaOH溶液
B.溶液A和B均可以选用稀硝酸
C.若溶液B选用浓硝酸,则测得铜的质量分数偏小
D.实验方案Ⅱ更便于实施
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省沭阳县高二上学期期中化学试卷(解析版) 题型:选择题
氯仿可用做全身麻醉剂,但在光照下,易被氧气氧化成剧毒的光气(COCl2):2CHCl3 + O2 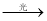 2HCl + 2COCl2。为防止发生医疗事故,在使用前要先检查是否变质,你认为检验用的最佳试剂是
2HCl + 2COCl2。为防止发生医疗事故,在使用前要先检查是否变质,你认为检验用的最佳试剂是
A.烧碱溶液 B.溴水 C.KI淀粉溶液 D.AgNO3溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省沭阳县高二上学期期中化学试卷(解析版) 题型:选择题
下列分子中含有手性碳原子的是
A.CF2Cl2 B.CH3CH2OH
 D.CH2=CH—COOH
D.CH2=CH—COOH
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省南京市高二上学期期中化学试卷(解析版) 题型:填空题
空气和水是人类生存和发展必不可少的自然资源,改善空气质量、合理利用水资源已成为全人类共识。
⑴今年9月以来北京地区发生严重雾霾天气,其中9月28日,各种污染物的污染指数为:二氧化硫86,二氧化氮71,可吸入颗粒物162,则该地区的空气污染指数为 ,首要污染物为 。
⑵汽车上加装尾气催化净化装置,可以使NO、CO相互反应转化为两种非污染性气体,写出该反应的化学反应方程式________________ 。
⑶明矾可用作废水处理的 剂,Al3+水解生成的 (填化学式)胶体能吸附水中的悬浮颗粒,并使之沉降。
⑷煤燃烧产生的SO2所形成的酸雨中,SO2最终转化成的酸是 (填化学式)。在煤中加入适量石灰石,可以大大减少煤燃烧时SO2的排放,发生反应的化学方程式为 。(请写出其总反应方程式)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省南京市高二上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.绿色食品就是指颜色为绿色的食品 B.白色污染是指白色的废弃物的污染
C.有机食品是指含有有机物的食品 D.食盐加碘实质是在食盐中加入KIO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省宝鸡市岐山县高一上期中质检化学卷(解析版) 题型:计算题
在标准状况下,将224.00L氯化氢气体溶于635.00mL的水(密度为1.00 g/cm3)中,所得盐酸的密度为1.18g/cm3。(要求有解题过程)
(1)该盐酸的质量分数是多少?
(2)取这种盐酸100.00mL,稀释到500.00 mL,所得的稀盐酸的物质的量浓度为多少?
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省宝鸡市岐山县高二上期中理化学卷(解析版) 题型:填空题
盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列的3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol
Fe2O3(s)+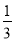 CO(g)=
CO(g)=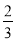 Fe3O4(s)+
Fe3O4(s)+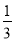 CO2(g)△H=-15.73kJ/mol
CO2(g)△H=-15.73kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.4kJ/mol
试写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com