
 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.| H2O | CO | CO2 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
| 容器编号 | c(CO)/mol•L-1 | c(O2))/mol•L-1 | c(CO2))/mol•L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
分析 (1)①结合化学平衡三段式列式计算,设消耗一氧化碳物质的量为x
CO (g)+H2O(g)?CO2(g)+H2(g)
起始量(mol) 0.2 0.2 0 0
变化量(mol) x x x x
平衡量(mol)0.2-x 0.2-x x x
800℃,在2L恒容密闭容器中达到平衡状态,K=l,
平衡常数K=$\frac{{x}^{2}}{(0.2-x)^{2}}$=1
x=0.1
反应速率v=$\frac{△c}{△t}$,转化率=$\frac{消耗量}{起始量}$×100%计算得到;
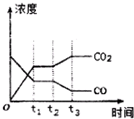
②由图可知,t2时刻后二氧化碳浓度增大,一氧化碳浓度减小,改变条件,平衡向正反应方向移动,结合平衡移动原理与反应特点分析解答;
(2)①I中正逆速率相等,处于平衡状态,根据I中数据计算该温度下平衡常数,再计算Ⅱ中浓度商,与平衡常数比较判断反应进行情况,进而确定正、逆反应速率关系;
②设平衡时CO的浓度变化量为xmol/L,利用三段式表示平衡时各组分的浓度,再利用平衡常数列方程计算;
(3)等体积混合后溶液中碳酸根的浓度为1×l0-4mol/L,利用溶度积计算需要钙离子浓度,再根据稀释定律计算所需CaCl2溶液的最小浓度.
解答 解:(1)①设消耗一氧化碳物质的量为x,
CO (g)+H2O(g)?CO2(g)+H2(g)
起始量(mol) 0.2 0.2 0 0
变化量(mol) x x x x
平衡量(mol)0.2-x 0.2-x x x
800℃,在2L恒容密闭容器中达到平衡状态,K=l,
平衡常数K=$\frac{{x}^{2}}{(0.2-x)^{2}}$=1,解得x=0.1,
生成物CO2表示该反应的反应速率v(CO2)=$\frac{△c}{△t}$=$\frac{\frac{0.1mol}{2L}}{5min}$=0.01mol/(L•min),
平衡时,容器中CO的转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.1mol}{0.2mol}$×100%=50%,
故答案为:0.01mol/(L•min);50%;
②由图可知,t2时刻后二氧化碳浓度增大,一氧化碳浓度减小,改变条件,平衡向正反应方向移动,反应是放热反应,可减低温度使平衡正向进行,或降低氢气的浓度或增大水蒸气的浓度,使平衡向正反应方向移动,
故答案为:降低温度或降低H2浓度或增大H2O(g)浓度;
(2)①I中正逆速率相等,处于平衡状态,该温度下平衡常数K=$\frac{4.{0}^{-2}}{2.0×1{0}^{-4}×(4×1{0}^{-4})^{\frac{1}{2}}}$=104,Ⅱ中浓度商Qc=$\frac{5×1{0}^{-2}}{3×1{0}^{-4}×(4×1{0}^{-4})^{\frac{1}{2}}}$=8.3×103<104,故反应向正反应进行,则v(正)>v(逆),
故答案为:>;
②设CO的浓度变化量为xmol/L,则:
CO(g)+$\frac{1}{2}$O2(g)?CO2(g)
起始(mol/L):1.0×10-5 1.0×10-4
变化(mol/L):x x
平衡(mol/L):1.0×10-5 -x 1.0×10-4 1.0×10-4+x
则$\frac{(1×1{0}^{-4}+x)}{(1×1{0}^{-5}-x)×(1×1{0}^{-4})^{\frac{1}{2}}}$=104,解得x=8.91×10-6mol/L,
故平衡时CO浓度为1.0×10-5mol-8.91×10-6mol=1.1×10-6mol/L
故答案为:1.1×10-6;
(3)等体积混合后溶液中碳酸根的浓度为2×l0-4mol/L÷2=1×l0-4mol/L,要生成CaCO3沉淀需要钙离子浓度为$\frac{2.8×1{0}^{-9}}{1×1{0}^{-4}}$mol/L=2.8×l0-5mol/L,故需要CaCl2溶液的最小浓度为2.8×l0-5mol/L×2=5.6×l0-5mol/L,
故答案为:5.6×10-5.
点评 本题属于拼合型题目,涉及化学反应速率计算、化学平衡移动、平衡常数应用、溶度积计算,难度中等,(3)中注意等体积混合后碳酸根的浓度变化情况.


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶于水 Na2CO3═Na22++CO32- | |
| B. | Al(OH)3酸式电离 Al(OH)3═H++AlO2-+H2O | |
| C. | NaHS溶于水HS-的电离 HS-+H2O?H2S+OH- | |
| D. | NaHCO3在水溶液中电离 NaHCO3═Na++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象及结论 |
| ①取粗产品于试管中,加入1.0 mol•L-1Na2CO3溶液,酯溶解度减小振荡分层,用分液漏斗分液,得到水层加入0.1 mol•L-1BaCl2溶液 | 白色沉淀生成,说明含有硫酸 |
| ②取①反应后的溶液于试管中,加入1 mol•L-1HCl溶液 | 出现白色晶体,证明含有苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质是Na2O. |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入适量BaCl2 | 有白色沉淀生成 | 白色物质是Na2CO3 |
| ②静置片刻,取上层清液于试管中… | …. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40 | B. | 18 | C. | 12 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素位于第5周期,ⅢB族 | B. | 该元素原子核外有5个电子层 | ||
| C. | 该元素原子最外层共有2个电子 | D. | 该元素原子M能层共有8个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{r}_{(p)}}{{r}_{(Si)}}$ | B. | $\frac{{r}_{(Be)}}{{r}_{(Mg)}}$ | C. | $\frac{{r}_{({K}^{+})}}{{r}_{(N{a}^{+})}}$ | D. | $\frac{{r}_{(cl)}}{{r}_{(c{l}^{-})}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、Mg2+、SO42- | B. | Ba2+、Na+、NO3-、HCO3- | ||
| C. | Na+、K+、S2-、CO32- | D. | Na+、S2- ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com