
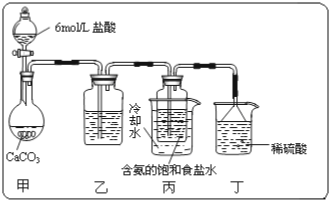
分析 (1)甲装置用于制备二氧化碳,二氧化碳中混有氯化氢,则乙为饱和碳酸氢钠溶液,用于除去氯化氢,二氧化碳和氨水在丙中发生反应NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl,生成碳酸氢钠,丁中稀硫酸用于吸收氨气,防止污染空气;
(2)碳酸氢钠分解生成碳酸钠,碳酸氢钠、碳酸钠与石灰水反应生成碳酸钙,根据碳酸钙的质量可列方程式确定碳酸钠的质量和质量分数.
解答 解:(1)①实验室用氢氧化钙和氯化铵在加热条件下反应制备氨气,反应的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
②利用盐酸制取二氧化碳时,因盐酸易挥发,所以,二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应不与二氧化碳反应,所以通过碳酸氢钠的溶液是可以除掉二氧化碳气体中的氯化氢气体,实验过程中氨气可能有剩余,而稀硫酸能与氨气反应,所以稀硫酸的作用是吸收末反应的NH3,
故答案为:饱和碳酸氢钠溶液;吸收未反应完的 NH3;
③分离出NaHCO3晶体的操作是分离固体与液体,常采用的实验操作是过滤操作,常用到的仪器有玻璃棒、烧杯和漏斗,故答案为:过滤; 漏斗、烧杯;
(2)碳酸氢钠受热发生的反应为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,与足量的石灰水充分反应,
NaHCO3+Ca(OH)2=CaCO3↓+H2O+NaOH;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
反应生成的碳酸钙物质的量为:$\frac{12g}{100g/mol}$=0.12mol;
设加热后的固体12.28g中含碳酸钠物质的量x、碳酸氢钠物质的量为y,依据题意得到:
①x+y=0.12、②106x+84y=12.28,
根据①②解得:x=0.1mol、y=0.02mol,
则所得固体中碳酸钠的质量分数为:$\frac{0.1mol×106g/mol}{12.28g}$×100%=86.3%,
故答案为:86.3%.
点评 本题考查性质实验方案的设计,是一道有关工业制纯碱知识的一道综合实验题目,为高频考点,题目难度中等,考查学生分析和解决问题的能力,掌握制碱原理是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | Al3+ | B. | Ba2+ | C. | Cl- | D. | Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
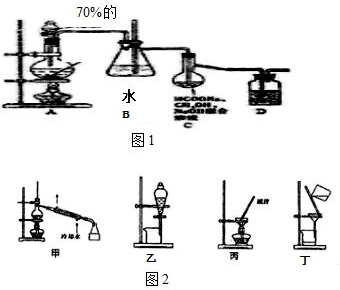
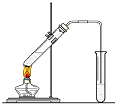 在实验室我们用如图所示的装置制取乙酸乙酯.回答下列问题:
在实验室我们用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
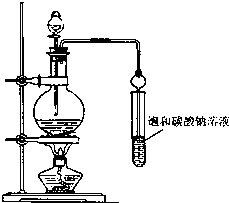 实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇和少量浓H2SO4混合,然后经分液漏斗边滴加醋酸,边加热蒸馏,直接收集蒸馏产品可得到含有乙醇、乙醚、醋酸、少量水的乙酸乙酯粗产品.据此回答问题:
实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇和少量浓H2SO4混合,然后经分液漏斗边滴加醋酸,边加热蒸馏,直接收集蒸馏产品可得到含有乙醇、乙醚、醋酸、少量水的乙酸乙酯粗产品.据此回答问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
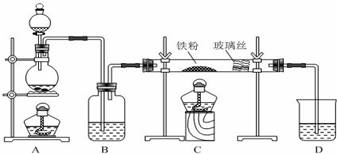
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
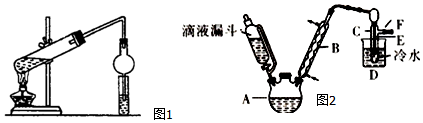
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
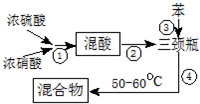
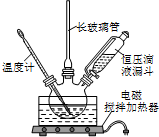 硝基苯是医药和染料的中间体,还可做有机溶剂.反应如图:
硝基苯是医药和染料的中间体,还可做有机溶剂.反应如图: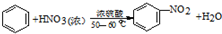
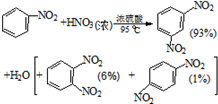
| 物质 | 熔点/ ℃ | 沸点 /℃ | 密度(20℃) /g•cm-3 | 水溶性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被氧化的元素是氯元素 | |
| B. | 氧化产物与还原产物的物质的量之比为l:1 | |
| C. | 消耗l mol还原剂,转移5 mol电子 | |
| D. | 净化1 L含CN-1.04 mg•L-1的废水,理论上需用2×l0-5mol C1O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com